摘要:(1)6.IVA. PbO2+2Cl-+ 4H+==Pb2++ Cl2↑+ 2H2O. SO2+PbO2==PbSO4 (2)2PbS+3O2==2PbO+2SO2 . CO+PbO==Pb+CO2 (3)PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O. 变小. 96 (4)(CH3CH2)4Pb . 避免铅污染大气
网址:http://m.1010jiajiao.com/timu3_id_378194[举报]
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题
Ⅰ.(1)请画出元素⑧的离子结构示意图 .
(2)元素⑦中质子数和中子数相等的同位素符号是 .
(3)④、⑤、⑦的原子半径由大到小的顺序为 .
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为 > .
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为 .
(6)周期表中,同一主族元素化学性质相似;同时有些元素和它在周期表中左上方或右下方的另一主族元素的化学性质也相似,如Li与Mg,这称为对角线规则.上表中与铍的化学性质相似的元素有(填元素名称) .铍的最高价氧化物对应水化物属于两性化合物,该化合物的化学式是 ,能够说明其具有两性的反应离子方程式为: ; .
Ⅱ.由表中①~⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答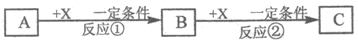
(1)若X是强氧化性单质,则A不可能是 (填序号).
a.S b.N2 c.Na d.Mg e.Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属阳离子的化学试剂 ,现象是 ;又知在酸性溶液中该金属阳离子能被双氧水氧化,写出该反应的离子方程式: .
(3)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,写出A与C两溶液反应的离子方程式: .
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)元素⑦中质子数和中子数相等的同位素符号是
(3)④、⑤、⑦的原子半径由大到小的顺序为
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为
(6)周期表中,同一主族元素化学性质相似;同时有些元素和它在周期表中左上方或右下方的另一主族元素的化学性质也相似,如Li与Mg,这称为对角线规则.上表中与铍的化学性质相似的元素有(填元素名称)
Ⅱ.由表中①~⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答

(1)若X是强氧化性单质,则A不可能是
a.S b.N2 c.Na d.Mg e.Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属阳离子的化学试剂
(3)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
如表是元素周期表的一部分.表中所列的字母分别代表某一化学元素,与实际元素符号无关.
(1)下列说法正确的是 .
A.第一电离能:A>B>E>J>K B.电负性:B>C>D>E>J
C.原子半径:F>G>H>E D.D、I分别与L形成的简单分子均为非极性分子
(2)表中A与E可形成A2E=E=EA2分子,有关该分子的说法不正确的是 .
A.分子中有6个σ键和2个π键
B.三个E原子都是sp2杂化
C.四个A原子不在同一平面内
D.三个E原子在同一条直线上
(3)F晶体的晶胞结构如图, 它的空间利用率为 (填“52%”、“68%”或“74%”).
它的空间利用率为 (填“52%”、“68%”或“74%”).
(4)字母K表示的元素原子基态时的价层电子排布式为 .
(5)MAL2晶体中包含的微粒间作用力有(填序号) .
①离子键 ②极性键 ③分子间作用力 ④金属键
(6)BHA4是一种络合物,中心原子配位数为 ,根据价层电子互斥理论可确定该物质中阴离子空间构型为 .
查看习题详情和答案>>
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | A | ||||||
| 2 | B | C | D | E | J | K | L |
| 3 | F | G | H | I | |||
| M |
A.第一电离能:A>B>E>J>K B.电负性:B>C>D>E>J
C.原子半径:F>G>H>E D.D、I分别与L形成的简单分子均为非极性分子
(2)表中A与E可形成A2E=E=EA2分子,有关该分子的说法不正确的是
A.分子中有6个σ键和2个π键
B.三个E原子都是sp2杂化
C.四个A原子不在同一平面内
D.三个E原子在同一条直线上
(3)F晶体的晶胞结构如图,
 它的空间利用率为
它的空间利用率为(4)字母K表示的元素原子基态时的价层电子排布式为
(5)MAL2晶体中包含的微粒间作用力有(填序号)
①离子键 ②极性键 ③分子间作用力 ④金属键
(6)BHA4是一种络合物,中心原子配位数为
表中的实线表示元素周期表的部分边界.①~⑩分别表示元素周期表中对应位置的元素.
(1)元素周期表体现了元素周期律,元素周期律的本质是
(2)元素③④⑤⑥的原子半径由大到小的顺序是:
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是
(4)按要求作图:⑤的原子结构示意图

(5)⑦与⑩中较活泼的是
(6)写出上图中元素“E”在周期表中的位置
查看习题详情和答案>>
| ⅢA | ⅦA | ||||||||||||||||
| ① | ② | ③ | |||||||||||||||
| ④ | ⅢB | ⅦB | ⅡB | ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||
| ⑨ | Fe | ⑩ | |||||||||||||||
| E | |||||||||||||||||
元素原子核外电子排布的周期性变化
元素原子核外电子排布的周期性变化
.(2)元素③④⑤⑥的原子半径由大到小的顺序是:
Na、Al、S、F
Na、Al、S、F
(用元素符号表示).(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是
HClO4
HClO4
(填写化学式,下同),其名称为高氯酸
高氯酸
;碱性最强的是KOH
KOH
,呈两性的是Al(OH)3
Al(OH)3
(4)按要求作图:⑤的原子结构示意图


(5)⑦与⑩中较活泼的是
氯
氯
(填写元素名称),用化学方程式表示原因Cl2+2NaBr=2NaCl+Br2
Cl2+2NaBr=2NaCl+Br2
(6)写出上图中元素“E”在周期表中的位置
第五周期第IVA族
第五周期第IVA族
.下表列出了A~R 9种元素在周期表中的位置:
(1)这9种元素中金属性最强的元素是
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
(3)A、B、C三种元素按原子半径由大到小的顺序排列为
(4)F元素氢化物的化学式是
(5)H元素跟A元素形成的化合物的化学式是
(6)G元素和H元素两者核电荷数之差是
查看习题详情和答案>>
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
K
K
,化学性质最不活泼的是Ar
Ar
(填元素符号,下同);(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(3)A、B、C三种元素按原子半径由大到小的顺序排列为
K>Na>Mg
K>Na>Mg
;(4)F元素氢化物的化学式是
H2O
H2O
,该氢化物在常温下跟B发生反应的化学方程式是2K+H2O=2KOH+H2↑
2K+H2O=2KOH+H2↑
,所得溶液的PH>
>
7;(5)H元素跟A元素形成的化合物的化学式是
NaBr
NaBr
,高温灼烧该化合物时,火焰呈现黄
黄
色;(6)G元素和H元素两者核电荷数之差是
18
18
.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: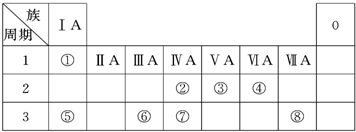
(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(如图):
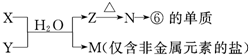
X溶液与Y溶液反应的离子方程式
N→⑥的单质的化学方程式为
M溶液中离子浓度由大到小的排列顺序是
M中阳离子的鉴定方法
查看习题详情和答案>>

(1)地壳中含量居于第二位的元素在周期表中的位置是
第三周期第IVA族
第三周期第IVA族
.(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
同一主族元素从上到下原子核外电子层数依次增多
同一主族元素从上到下原子核外电子层数依次增多
,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式


(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
c
c
.a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 还原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |

X溶液与Y溶液反应的离子方程式
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
,N→⑥的单质的化学方程式为
2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
,
| ||
| 冰晶石 |
M溶液中离子浓度由大到小的排列顺序是
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-)
,M中阳离子的鉴定方法
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
.