题目内容
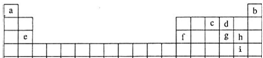
如表是元素周期表的一部分.表中所列的字母分别代表某一化学元素,与实际元素符号无关.
(1)下列说法正确的是 .
A.第一电离能:A>B>E>J>K B.电负性:B>C>D>E>J
C.原子半径:F>G>H>E D.D、I分别与L形成的简单分子均为非极性分子
(2)表中A与E可形成A2E=E=EA2分子,有关该分子的说法不正确的是 .
A.分子中有6个σ键和2个π键
B.三个E原子都是sp2杂化
C.四个A原子不在同一平面内
D.三个E原子在同一条直线上
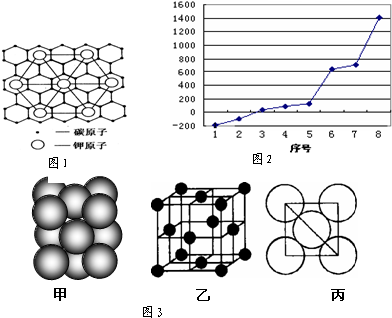
(3)F晶体的晶胞结构如图, 它的空间利用率为 (填“52%”、“68%”或“74%”).
它的空间利用率为 (填“52%”、“68%”或“74%”).
(4)字母K表示的元素原子基态时的价层电子排布式为 .
(5)MAL2晶体中包含的微粒间作用力有(填序号) .
①离子键 ②极性键 ③分子间作用力 ④金属键
(6)BHA4是一种络合物,中心原子配位数为 ,根据价层电子互斥理论可确定该物质中阴离子空间构型为 .
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | A | ||||||
| 2 | B | C | D | E | J | K | L |
| 3 | F | G | H | I | |||
| M |
A.第一电离能:A>B>E>J>K B.电负性:B>C>D>E>J
C.原子半径:F>G>H>E D.D、I分别与L形成的简单分子均为非极性分子
(2)表中A与E可形成A2E=E=EA2分子,有关该分子的说法不正确的是
A.分子中有6个σ键和2个π键
B.三个E原子都是sp2杂化
C.四个A原子不在同一平面内
D.三个E原子在同一条直线上
(3)F晶体的晶胞结构如图,
 它的空间利用率为
它的空间利用率为(4)字母K表示的元素原子基态时的价层电子排布式为
(5)MAL2晶体中包含的微粒间作用力有(填序号)
①离子键 ②极性键 ③分子间作用力 ④金属键
(6)BHA4是一种络合物,中心原子配位数为
分析:由元素在周期表中的位置可知,A为氢元素,B为Li、C为Be、D为B元素、E为碳元素、F为Na、G为Mg、H为Al、I为Si、J为氮元素、K为氧元素、L为F元素、M为钾元素,
(1)A.同周期自左而右第一电离能呈增大趋势,N元素的2p能级为半满稳定状态,第一电离能高于同周期相邻元素,一般非金属性越强第一电离能越大;
B.同周期自左而右电负性增大;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
D.根据价层电子对互斥理论判断分子空间构型,根据正负电荷重心是否重合判断分子极性;
(2)A.单键为σ键,双键中含有1个σ键、1个π键;
B.根据E成的σ键数目及孤对电子对数确定杂化方式;
C.根据E原子杂化方式,判断分子空间构型,据此判断;
D.根据分子中中间E原子杂化方式,判断3个E原子空间构型;
(3)Na晶胞为体心立方,令原子半径为r、晶胞棱长为l,晶胞体对角线为4r,则3l2=(4r)2,故l=
,计算晶胞的体积,计算晶胞中Na原子数目、进而计算Na原子总体积,空间利用率=
×100%;
(4)O元素原子有2个电子层,第二电子层含有电子数为6,结合核外电子排布规律书写;
(5)KHF2晶体属于离子晶体,晶体中H、F原子之间形成极性键;
(6)LiAlH4是一种络合物,配离子AlH4-中心Al原子配体为4个H原子,计算Al原子价层电子对数与孤对电子对,确定空间结构.
(1)A.同周期自左而右第一电离能呈增大趋势,N元素的2p能级为半满稳定状态,第一电离能高于同周期相邻元素,一般非金属性越强第一电离能越大;
B.同周期自左而右电负性增大;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
D.根据价层电子对互斥理论判断分子空间构型,根据正负电荷重心是否重合判断分子极性;
(2)A.单键为σ键,双键中含有1个σ键、1个π键;
B.根据E成的σ键数目及孤对电子对数确定杂化方式;
C.根据E原子杂化方式,判断分子空间构型,据此判断;
D.根据分子中中间E原子杂化方式,判断3个E原子空间构型;
(3)Na晶胞为体心立方,令原子半径为r、晶胞棱长为l,晶胞体对角线为4r,则3l2=(4r)2,故l=
| ||
| 4 |
| Na原子总体积 |
| 晶胞体积 |
(4)O元素原子有2个电子层,第二电子层含有电子数为6,结合核外电子排布规律书写;
(5)KHF2晶体属于离子晶体,晶体中H、F原子之间形成极性键;
(6)LiAlH4是一种络合物,配离子AlH4-中心Al原子配体为4个H原子,计算Al原子价层电子对数与孤对电子对,确定空间结构.
解答:解:由元素在周期表中的位置可知,A为氢元素,B为Li、C为Be、D为B元素、E为碳元素、F为Na、G为Mg、H为Al、I为Si、J为氮元素、K为氧元素、L为F元素、M为钾元素,
(1)A.同周期自左而右第一电离能呈增大趋势,N元素的2p能级为半满稳定状态,第一电离能高于同周期相邻元素,一般非金属性越强第一电离能越大,故第一电离能N>O>C>H>Li,故A错误;
B.同周期自左而右电负性增大,故电负性B<C<D<E<J,故B错误;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径F>G>H>E,故C正确;
D.B、Si分别与F形成的简单分子分别为BF3、SiF4,BF3分子中B原子价层电子对数=3+
=3、不含孤对电子,故其为平面正三角形,分子中正负电荷重心重合,为非极性分子;SiF4分子中Si原子价层电子对数=4、不含孤对电子,故其为平面正三角形,分子中正负电荷重心重合,为非极性分子,故D正确,
故答案为:CD;
(2)A2E=E=EA2分子为H2C=C=CH2,
A.单键为σ键,双键中含有1个σ键、1个π键,故H2C=C=CH2分子中有6个σ键和2个π键,故A正确;
B.H2C=C=CH2分子中中间C原子成2个σ键、不含孤对电子,杂化轨道数目为2,采取sp杂化,两端C原子都成3个σ键、不含孤对电子,杂化轨道数目为3,采取sp2杂化,三个碳原子杂化方式不同,故B错误;
C.H2C=C=CH2分子中中间C原子成2个σ键、不含孤对电子,杂化轨道数目为2,采取sp杂化,3个碳原子处于同一直线;两端C原子都成3个σ键、不含孤对电子,杂化轨道数目为3,采取sp2杂化,为平面三角形结构,故该分子为平面结构,所有原子处于同一平面,故C错误;
D.H2C=C=CH2分子中中间C原子成2个σ键、不含孤对电子,杂化轨道数目为2,采取sp杂化,3个碳原子处于同一直线,故D正确,
故答案为:BC;
(3)Na晶胞为体心立方,令原子半径为r、晶胞棱长为l,晶胞体对角线为4r,则3l2=(4r)2,故l=
,晶胞的体积=(
)3=
,晶胞中Na原子数目=1+8×
=2、晶胞中Na原子总体积=2×
πr3,故晶胞空间利用率=
×100%≈68%,
故答案为:68%;
(4)O元素原子有2个电子层,第二电子层含有电子数为6,故原子基态时的价层电子排布式为2s22p4,
故答案为:2s22p4;
(5)KHF2晶体属于离子晶体,含有离子键,晶体中H、F原子之间形成极性键,
故答案为:①②;
(6)LiAlH4是一种络合物,配离子AlH4-中心Al原子配体为4个H原子,Al原子价层电子对数=4+
=4、不含孤对电子,故AlH4-为正四面体结构,
故答案为:4;正四面体.
(1)A.同周期自左而右第一电离能呈增大趋势,N元素的2p能级为半满稳定状态,第一电离能高于同周期相邻元素,一般非金属性越强第一电离能越大,故第一电离能N>O>C>H>Li,故A错误;
B.同周期自左而右电负性增大,故电负性B<C<D<E<J,故B错误;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径F>G>H>E,故C正确;
D.B、Si分别与F形成的简单分子分别为BF3、SiF4,BF3分子中B原子价层电子对数=3+
| 3-1×3 |
| 2 |
故答案为:CD;
(2)A2E=E=EA2分子为H2C=C=CH2,
A.单键为σ键,双键中含有1个σ键、1个π键,故H2C=C=CH2分子中有6个σ键和2个π键,故A正确;
B.H2C=C=CH2分子中中间C原子成2个σ键、不含孤对电子,杂化轨道数目为2,采取sp杂化,两端C原子都成3个σ键、不含孤对电子,杂化轨道数目为3,采取sp2杂化,三个碳原子杂化方式不同,故B错误;
C.H2C=C=CH2分子中中间C原子成2个σ键、不含孤对电子,杂化轨道数目为2,采取sp杂化,3个碳原子处于同一直线;两端C原子都成3个σ键、不含孤对电子,杂化轨道数目为3,采取sp2杂化,为平面三角形结构,故该分子为平面结构,所有原子处于同一平面,故C错误;
D.H2C=C=CH2分子中中间C原子成2个σ键、不含孤对电子,杂化轨道数目为2,采取sp杂化,3个碳原子处于同一直线,故D正确,
故答案为:BC;
(3)Na晶胞为体心立方,令原子半径为r、晶胞棱长为l,晶胞体对角线为4r,则3l2=(4r)2,故l=
4
| ||
| 3 |
4
| ||
| 3 |
64
| ||
| 9 |
| 1 |
| 8 |
| 4 |
| 3 |
| ||||
|
故答案为:68%;
(4)O元素原子有2个电子层,第二电子层含有电子数为6,故原子基态时的价层电子排布式为2s22p4,
故答案为:2s22p4;
(5)KHF2晶体属于离子晶体,含有离子键,晶体中H、F原子之间形成极性键,
故答案为:①②;
(6)LiAlH4是一种络合物,配离子AlH4-中心Al原子配体为4个H原子,Al原子价层电子对数=4+
| 3+1-4 |
| 2 |
故答案为:4;正四面体.
点评:本题考查物质结构与性质,涉及元素周期表、元素周期律、杂化理论、化学键、分子结构与性质、晶胞计算等,难度较大,(3)为易错点、难点,理解晶胞结构性质原子半径与晶胞棱长关系是关键.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目