摘要:回答下列问题: (1)在步骤②加入的试剂x.最佳选择是 A. 漂液 450元/t B. H2O2(30%) 2400元/t C. NaOH (98%) 2100元/t D. Na2CO3 600元/t (2)写出下列化学式:B是 .气体C是 (3)写出沉淀A的离子方程式 (4)如何检验所得的轻质氧化镁为纯净? (5)步骤⑤水中煮沸的目的是
网址:http://m.1010jiajiao.com/timu3_id_377758[举报]
某小组为证明同温同压下,同浓度,同体积的酸性不同的两种二元酸与足量镁带反应时生成H2量相同而反应速率不同,装置如图.主要步骤如下:
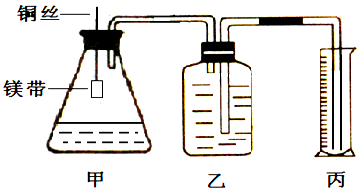
(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用
(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录
(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性
(2)用ρ=1.84 98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有
(3)读取量筒内水体积时,必须注意的问题是
(4)简述速率不等的原因
(5)此实验说明草酸为弱酸,请再设计一实验证明:
查看习题详情和答案>>

(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用
酸式滴定管
酸式滴定管
量取10.00mL0.5mol/L的硫酸和草酸溶液分别加入两锥形瓶中;(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录
反应所需时间
反应所需时间
;(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气.
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气.
;(2)用ρ=1.84 98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
、烧杯、玻璃棒、酸式滴定管等;(3)读取量筒内水体积时,必须注意的问题是
读数时保持乙丙中液面相平;待装置冷却至室温再读数
读数时保持乙丙中液面相平;待装置冷却至室温再读数
;(4)简述速率不等的原因
H+浓度不同
H+浓度不同
,铜丝不能与酸接触的原因与铜易形成原电池,加快反应速率,干扰实验测定
与铜易形成原电池,加快反应速率,干扰实验测定
;(5)此实验说明草酸为弱酸,请再设计一实验证明:
测定草酸钠溶液的PH,如大于7,则为弱酸
测定草酸钠溶液的PH,如大于7,则为弱酸
.(2009?金华模拟)马格尼特法冶炼镁的工艺流程如图.炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的主要目的是降低渣的熔点,便于液态排渣.已知白云石的成分为CaCO3?MgCO3,硅铁是指含有55%硅左右的合金,作还原剂,最后得到低品位的硅铁含硅量少的合金,简易流程图如下:
试回答下列问题
(1)反应①白云石煅烧得CaO?MgO的化学方程式为:
(2)反应②还原炉中发生反应生成镁和炉渣的化学方程式为:
(3)沪渣是一种工业生产的重要原料,可作为生产
(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁
查看习题详情和答案>>

试回答下列问题
(1)反应①白云石煅烧得CaO?MgO的化学方程式为:
CaCO3?MgCO3
CaO?MgO+2CO2↑
| ||
CaCO3?MgCO3
CaO?MgO+2CO2↑
| ||
(2)反应②还原炉中发生反应生成镁和炉渣的化学方程式为:
2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3
| ||
2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3
| ||
(3)沪渣是一种工业生产的重要原料,可作为生产
水泥
水泥
的原料.(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁
7.0
7.0
吨(假设硅全部反应)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题
(1)该反应的化学平衡常数表达式为K=
.
(2)上述正向反应是:
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向
(4)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
(6)在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
查看习题详情和答案>>
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的化学平衡常数表达式为K=
| [H2]?[CO2] |
| [CO]?[H2O] |
| [H2]?[CO2] |
| [CO]?[H2O] |
(2)上述正向反应是:
放热
放热
反应(选填:放热、吸热).(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向
逆
逆
反应方向移动(填“正”或“逆”),正反应速率增大
增大
(填“增大”、“减小”或“不变”),容器内混合气体的压强不变
不变
(填“增大”、“减小”或“不变”).(4)能判断该反应是否达到化学平衡状态的依据是
bc
bc
(多选扣分).a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃.(6)在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
BC
BC
(选填A、B、C、D).| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
(1)请写出该实验的实验步骤
①
(2)所需仪器为:容量瓶、托盘天平、还需要哪些实验仪器才能完成该实验,请写出:
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因.
定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响
查看习题详情和答案>>
(1)请写出该实验的实验步骤
①
计算
计算
,②称量
称量
,③溶解转移
溶解转移
,④洗涤转移
洗涤转移
,⑤定容摇匀
定容摇匀
.(2)所需仪器为:容量瓶、托盘天平、还需要哪些实验仪器才能完成该实验,请写出:
烧杯、药匙、玻璃棒、胶头滴管
烧杯、药匙、玻璃棒、胶头滴管
.(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因.
定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响
偏低
偏低
,(偏高、偏低、无影响)原因是配制溶液的体积大于500mL
配制溶液的体积大于500mL
.今有A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C、B与D分别是同族元素.B、D两元素的质子数之和是A、C两元素质子数之和的2倍.这四种元素中有一种元素的单质呈淡黄色.根据你的推断回答下列问题
(1)四种元素的名称分别是:A
(2)请写出含B质量分数最高的化合物的化学式:
(3)写出由上述元素形成的具有漂白作用的四种物质的化学式:
(4)画出C离子结构示意图
 ,写出比C少一个质子的原子的电子式
,写出比C少一个质子的原子的电子式

(5)分别写出由A、B两元素形成两种化合物的化学式
(6)分别用电子式写出A2B2、C2B2的形成过程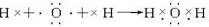
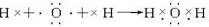 、
、

(7)写出NH4Cl的电子式:
 ,CO2的电子式:
,CO2的电子式:
 .
.
查看习题详情和答案>>
(1)四种元素的名称分别是:A
氢
氢
,B氧
氧
,C钠
钠
,D硫
硫
(2)请写出含B质量分数最高的化合物的化学式:
H2O2
H2O2
(3)写出由上述元素形成的具有漂白作用的四种物质的化学式:
Na2O2
Na2O2
、O3
O3
、H2O2
H2O2
、SO2
SO2
(4)画出C离子结构示意图




(5)分别写出由A、B两元素形成两种化合物的化学式
H2O
H2O
、H2O2
H2O2
(6)分别用电子式写出A2B2、C2B2的形成过程
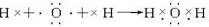
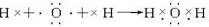


(7)写出NH4Cl的电子式:



