题目内容
(2009?金华模拟)马格尼特法冶炼镁的工艺流程如图.炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的主要目的是降低渣的熔点,便于液态排渣.已知白云石的成分为CaCO3?MgCO3,硅铁是指含有55%硅左右的合金,作还原剂,最后得到低品位的硅铁含硅量少的合金,简易流程图如下:
试回答下列问题
(1)反应①白云石煅烧得CaO?MgO的化学方程式为:
(2)反应②还原炉中发生反应生成镁和炉渣的化学方程式为:
(3)沪渣是一种工业生产的重要原料,可作为生产
(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁

试回答下列问题
(1)反应①白云石煅烧得CaO?MgO的化学方程式为:
CaCO3?MgCO3
CaO?MgO+2CO2↑
| ||
CaCO3?MgCO3
CaO?MgO+2CO2↑
| ||
(2)反应②还原炉中发生反应生成镁和炉渣的化学方程式为:
2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3
| ||
2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3
| ||
(3)沪渣是一种工业生产的重要原料,可作为生产
水泥
水泥
的原料.(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁
7.0
7.0
吨(假设硅全部反应)分析:(1)难溶性的碳酸盐高温下分解为氧化物和二氧化碳;
(2)根据还原炉中的炉渣来书写化学方程式;
(3)炉渣2CaO?SiO2?0.3Al2O3是生产水泥的原料;
(4)根据化学方程式进行计算.
(2)根据还原炉中的炉渣来书写化学方程式;
(3)炉渣2CaO?SiO2?0.3Al2O3是生产水泥的原料;
(4)根据化学方程式进行计算.
解答:解:(1)难溶性的碳酸盐碳酸钙和碳酸镁在高温下分解为氧化物和二氧化碳,即CaCO3?MgCO3
CaO?MgO+2CO2↑,
故答案为:CaCO3?MgCO3
CaO?MgO+2CO2↑;
(2)根据还原炉中的炉渣为2CaO?SiO2?0.3Al2O3,结合原子守恒,可以得出化学方程式为:2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3,故答案为:2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3;
(3)沪渣2CaO?SiO2?0.3Al2O3可作为生水泥的原料,故答案为:水泥;
(4)根据化学方程式:2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3,当生成7.2吨镁消耗硅的质量为:
=4.2g,所需含硅60%的硅铁质量为:
=7.0(t),故答案为:7.0.
| ||
故答案为:CaCO3?MgCO3
| ||
(2)根据还原炉中的炉渣为2CaO?SiO2?0.3Al2O3,结合原子守恒,可以得出化学方程式为:2(CaO?MgO)+Si+0.3Al2O3
| ||
| ||
(3)沪渣2CaO?SiO2?0.3Al2O3可作为生水泥的原料,故答案为:水泥;
(4)根据化学方程式:2(CaO?MgO)+Si+0.3Al2O3
| ||
| 28×7.2 |
| 48 |
| 4.2 |
| 60% |
点评:本题考查学生镁和铝的化合物的有关知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
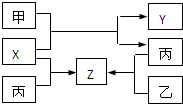 (2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系:
(2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系: