题目内容
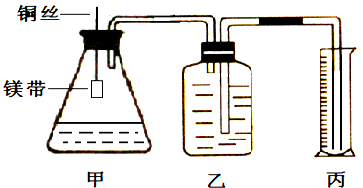
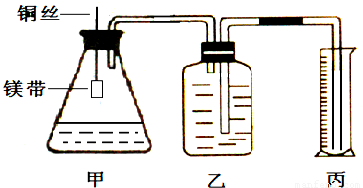
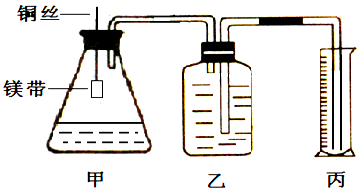
某小组为证明同温同压下,同浓度,同体积的酸性不同的两种二元酸与足量镁带反应时生成H2量相同而反应速率不同,装置如图.主要步骤如下:
(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用
(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录
(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性
(2)用ρ=1.84 98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有
(3)读取量筒内水体积时,必须注意的问题是
(4)简述速率不等的原因
(5)此实验说明草酸为弱酸,请再设计一实验证明:

(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用
酸式滴定管
酸式滴定管
量取10.00mL0.5mol/L的硫酸和草酸溶液分别加入两锥形瓶中;(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录
反应所需时间
反应所需时间
;(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气.
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气.
;(2)用ρ=1.84 98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
、烧杯、玻璃棒、酸式滴定管等;(3)读取量筒内水体积时,必须注意的问题是
读数时保持乙丙中液面相平;待装置冷却至室温再读数
读数时保持乙丙中液面相平;待装置冷却至室温再读数
;(4)简述速率不等的原因
H+浓度不同
H+浓度不同
,铜丝不能与酸接触的原因与铜易形成原电池,加快反应速率,干扰实验测定
与铜易形成原电池,加快反应速率,干扰实验测定
;(5)此实验说明草酸为弱酸,请再设计一实验证明:
测定草酸钠溶液的PH,如大于7,则为弱酸
测定草酸钠溶液的PH,如大于7,则为弱酸
.分析:(1)根据酸式滴定管和碱式滴定管的使用要求来选择;从检查装置的气密性的原理来考虑;
(2)根据配制一定物质的量浓度的溶液操作步骤来选择仪器;
(3)读数时要保持左右气体压强相等,以减少误差;
(4)从影响化学反应速率的因素来分析;
(5)从弱电解质存在电离平衡、不完全电离等角度选择证明方法.
(2)根据配制一定物质的量浓度的溶液操作步骤来选择仪器;
(3)读数时要保持左右气体压强相等,以减少误差;
(4)从影响化学反应速率的因素来分析;
(5)从弱电解质存在电离平衡、不完全电离等角度选择证明方法.
解答:解:酸溶液应用酸式滴定管量取,如用碱式滴定管会腐蚀橡胶管;比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,故答案为:酸式滴定管;反应所需时间;
(1)如不漏气,加热时容器内压强增大,会有气泡冒出,故答案为:往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气;
(2)配制溶液所需仪器有:250ml容量瓶、烧杯、玻璃棒、量筒或滴定管、胶头滴管等.故答案为:250ml容量瓶、胶头滴管;
(3)读数时要保持左右气体压强相等,以减少误差,故答案为:读数时保持乙丙中液面相平;待装置冷却至室温再读数;
(4)影响化学反应速率的因素有浓度、温度、压强等,本题为浓度不同,为测定镁与酸反应的速率,不能将铜丝与酸接触,否则易形成原电池,加快反应速率,干扰实验测定,
故答案为:H+浓度不同;与铜易形成原电池,加快反应速率,干扰实验测定;
(5)弱电解质存在电离平衡、不完全电离等性质,可任意选择合理方法,故答案为:测定草酸钠溶液的PH,如大于7,则为弱酸(其它合理答案也可以).
(1)如不漏气,加热时容器内压强增大,会有气泡冒出,故答案为:往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气;
(2)配制溶液所需仪器有:250ml容量瓶、烧杯、玻璃棒、量筒或滴定管、胶头滴管等.故答案为:250ml容量瓶、胶头滴管;
(3)读数时要保持左右气体压强相等,以减少误差,故答案为:读数时保持乙丙中液面相平;待装置冷却至室温再读数;
(4)影响化学反应速率的因素有浓度、温度、压强等,本题为浓度不同,为测定镁与酸反应的速率,不能将铜丝与酸接触,否则易形成原电池,加快反应速率,干扰实验测定,
故答案为:H+浓度不同;与铜易形成原电池,加快反应速率,干扰实验测定;
(5)弱电解质存在电离平衡、不完全电离等性质,可任意选择合理方法,故答案为:测定草酸钠溶液的PH,如大于7,则为弱酸(其它合理答案也可以).
点评:本题为实验探究题,注意实验基本操作,草酸为弱酸,证明方法较多,可以从以下角度思考:
1测草酸溶液的pH
2取pH相同的盐酸和草酸,稀释相同的倍数,测pH变化这三种方法均是检验草酸中是否存在电离平衡.
3.取浓度相同的盐酸和草酸,测pH,若为强酸,pH应相等,若为弱酸,pH大于盐酸,
4.直接测0.1mol/L的草酸溶液的pH 若为强酸,pH=1若为弱酸,pH>1
5.pH=2的草酸和pH=12的NaOH溶液等体积混合,测混合后溶液的pH
6.草酸与草酸钠1:1混合于同一溶液中,测草酸的pH变化
1测草酸溶液的pH
2取pH相同的盐酸和草酸,稀释相同的倍数,测pH变化这三种方法均是检验草酸中是否存在电离平衡.
3.取浓度相同的盐酸和草酸,测pH,若为强酸,pH应相等,若为弱酸,pH大于盐酸,
4.直接测0.1mol/L的草酸溶液的pH 若为强酸,pH=1若为弱酸,pH>1
5.pH=2的草酸和pH=12的NaOH溶液等体积混合,测混合后溶液的pH
6.草酸与草酸钠1:1混合于同一溶液中,测草酸的pH变化

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目