网址:http://m.1010jiajiao.com/timu3_id_377533[举报]
 (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116KJ?mol-1
又知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则甲醇的燃烧热为
(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2,5min后达平衡时CH3OH物质的量为2mol.该反应的速率v(H2)为
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.使用高效催化剂
d.增大体系压强
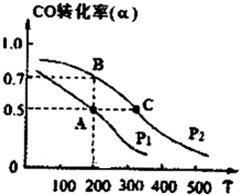
(3)在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示.
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA
②若A点时容器的体积为10L,该温度下B点的平衡常数K=
(4)Na2SO3的水溶液呈
(已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9).
煤的气化是高效、清洁地利用煤炭的重要途径之一。
(1)在250C 101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为
___________
又知: ①C(s)+O2(g)═CO2(g) △H=-393.5kJ/mol
②CO(g)+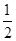 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g) △H=____kJ/mol
(2) CO可以与H2O(g)进一步发生反应: CO(g)+H2O(g)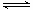 CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
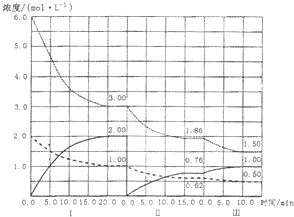
(3) 工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应反应N2(g)+3H2(g 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为________;
②由第一次平衡到第二次平衡,平衡移动的方向 是________,采取的措施是________。
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2________T3填“〉、=、<”判断的理由是________________。
查看习题详情和答案>>
煤的气化是高效、清洁地利用煤炭的重要途径之一。
(1)在250C 101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为
___________
又知: ①C(s)+O2(g)═CO2(g) △H=-393.5kJ/mol
②CO(g)+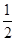 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g) △H=____kJ/mol
(2) CO可以与H2O(g)进一步发生反应: CO(g)+H2O(g) CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
(3) 工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应反应N2(g)+3H2(g 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为________;
②由第一次平衡到第二次平衡,平衡移动的方向 是________,采取的措施是________。
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2________T3填“〉、=、<”判断的理由是________________。
(1)在250C 101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为
___________
又知: ①C(s)+O2(g)═CO2(g) △H=-393.5kJ/mol
②CO(g)+
 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g) △H=____kJ/mol
(2) CO可以与H2O(g)进一步发生反应: CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。(3) 工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应反应N2(g)+3H2(g
 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为________;
②由第一次平衡到第二次平衡,平衡移动的方向 是________,采取的措施是________。
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2________T3填“〉、=、<”判断的理由是________________。
(1)在250C 101kPa时,H2与02化合生成1mol H2O(g)放出241.8kJ的热量,其热化学 方程式为
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
| 1 |
| 2 |
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)?CO(g)+Hi(g)△H=
(2)CO可以与H2CXg)进一步发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0在恒容密闭容器中,起始时n(H20)=0.20mol,n(CO)=0.10mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是(计算结果保留一位小数).
(3)工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应N2(g)+3H2(g)
| 催化剂 |
①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为
②由第一次平衡到第二次平衡,平衡移动的方向是
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2