题目内容
煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)在250C 101kPa时,H2与02化合生成1mol H2O(g)放出241.8kJ的热量,其热化学 方程式为
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)?CO(g)+Hi(g)△H= kj/mol.
(2)CO可以与H2CXg)进一步发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0在恒容密闭容器中,起始时n(H20)=0.20mol,n(CO)=0.10mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是(计算结果保留一位小数).
(3)工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应N2(g)+3H2(g)
2NH3((g) (△H<0)在等容条件下进行.改变其他反应条件,在I、II、III阶段体 系中各物质浓度随时间变化的曲线如图所示:
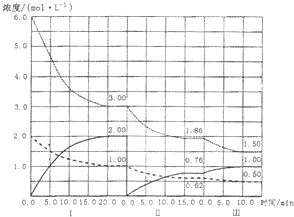
①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为 ;
②由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2 T3填“>、=、<”判断的理由是 .
(1)在250C 101kPa时,H2与02化合生成1mol H2O(g)放出241.8kJ的热量,其热化学 方程式为
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
| 1 |
| 2 |
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)?CO(g)+Hi(g)△H=
(2)CO可以与H2CXg)进一步发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0在恒容密闭容器中,起始时n(H20)=0.20mol,n(CO)=0.10mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是(计算结果保留一位小数).
(3)工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应N2(g)+3H2(g)
| 催化剂 |

①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为
②由第一次平衡到第二次平衡,平衡移动的方向是
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2
分析:(1)依据热化学方程式书写方法写出,标注物质聚集状态和对应焓变;依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)依据化学平衡三段式列式,结合消耗量除以起始量计算转化率;
(3)根据化学反应速率为单位时间浓度的变化值,可计算三个阶段用氮气表示的化学反应速率,据此判断;第二阶段氨气是从0开始的,瞬间氮气、氢气浓度不变,因此可以确定第一次平衡后从体系中移出了氨气,即减少生成物浓度,平衡正向移动;此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变;
(2)依据化学平衡三段式列式,结合消耗量除以起始量计算转化率;
(3)根据化学反应速率为单位时间浓度的变化值,可计算三个阶段用氮气表示的化学反应速率,据此判断;第二阶段氨气是从0开始的,瞬间氮气、氢气浓度不变,因此可以确定第一次平衡后从体系中移出了氨气,即减少生成物浓度,平衡正向移动;此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变;
解答:解:(1)在250C 101kPa时,H2与02化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为H2(g)+
O2(g)=H2O(g)△H=-241.8KJ/mol;
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol
③H2(g)+
O2(g)=H2O(g)△H=-241.8KJ/mol
依据盖斯定律①-②-③,得到焦炭与水蒸气反应的热化学方程式,C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3KJ/mol;
故答案为:H2(g)+
O2(g)=H2O(g)△H=-241.8KJ/mol,+131.3;
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0在恒容密闭容器中,起始时n(H20)=0.20mol,n(CO)=0.10mol,在8000C时达到平衡状态,K=1.0,则平衡时,设一氧化碳转化物质的量为x,依据化学平衡三段式列式;
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 0.10 0.20 0 0
变化量(mol) x x x x
平衡量(mol)0.10-x 0.20-x x x
K=
=1
计算得到x=
mol,
容器中CO的转化率=
×100%=66.7%;
故答案为:66.7%;
(3)①.vⅠ(N2)=
=0.05mol/(L?min),vⅡ(N2)=
=0.0253mol/(L?min),
vⅢ(N2)=
=0.012mol/(L?min),
故N2的平均反应速率vⅠ(N2)>vⅡ(N2)>vⅢ(N2);
故答案为:vⅠ(N2)>vⅡ(N2)>vⅢ(N2);
②.由第一次平衡到第二次平衡,氨气是从0开始的,瞬间氮气、氢气浓度不变,因此可以确定第一次平衡后从体系中移出了氨气,即减少生成物浓度,平衡正向移动;
故答案为:正反应方向,从反应体系中移出产物氨气;
③.第三阶段的开始与第二阶段的平衡各物质的量均相等,根据氮气、氢气的量减少,氨气的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,因此达到平衡后温度一定比第二阶段平衡时的温度低;
故答案为:>,此反应为放热反应,降低温度平衡向正反应方向移动.
| 1 |
| 2 |
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
依据盖斯定律①-②-③,得到焦炭与水蒸气反应的热化学方程式,C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3KJ/mol;
故答案为:H2(g)+
| 1 |
| 2 |
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0在恒容密闭容器中,起始时n(H20)=0.20mol,n(CO)=0.10mol,在8000C时达到平衡状态,K=1.0,则平衡时,设一氧化碳转化物质的量为x,依据化学平衡三段式列式;
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 0.10 0.20 0 0
变化量(mol) x x x x
平衡量(mol)0.10-x 0.20-x x x
K=
| x2 |
| (0.10-x)(0.20-x) |
计算得到x=
| 1 |
| 15 |
容器中CO的转化率=
| ||
| 0.10 |
故答案为:66.7%;
(3)①.vⅠ(N2)=
| 1mol/L |
| 20min |
| 1mol/L-0.62mol/L |
| 15min |
vⅢ(N2)=
| 0.62mol/L-0.5mol/L |
| 10min |
故N2的平均反应速率vⅠ(N2)>vⅡ(N2)>vⅢ(N2);
故答案为:vⅠ(N2)>vⅡ(N2)>vⅢ(N2);
②.由第一次平衡到第二次平衡,氨气是从0开始的,瞬间氮气、氢气浓度不变,因此可以确定第一次平衡后从体系中移出了氨气,即减少生成物浓度,平衡正向移动;
故答案为:正反应方向,从反应体系中移出产物氨气;
③.第三阶段的开始与第二阶段的平衡各物质的量均相等,根据氮气、氢气的量减少,氨气的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,因此达到平衡后温度一定比第二阶段平衡时的温度低;
故答案为:>,此反应为放热反应,降低温度平衡向正反应方向移动.
点评:本题考查化学反应速率与化学平衡图象、化学平衡有关计算、化学反应速率、化学平衡影响因素等,难度中等,学生容易只考虑改变瞬间各物质的浓度,不注意平衡时各物质浓度的变化量.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
 (2012?烟台一模)煤的气化是高效、清洁的利用煤炭的重要途径之一.
(2012?烟台一模)煤的气化是高效、清洁的利用煤炭的重要途径之一.

 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:

