网址:http://m.1010jiajiao.com/timu3_id_377314[举报]
| 元素编号 | a | b | c | d | e | f | g | h | i |
| 原子半径/nm | 0.037 | 0.064 | 0.073 | 0.070 | 0.088 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或 最低化合价 |
+1 | -1 | -2 | -3 | +3 | -2 | +3 | +1 | +1 |
(2)写出g的单质与i的最高价氧化物的水化物反应的离子方程式
(3)a的单质与c的单质在碱性条件下可组成一种燃料电池,该电池的负极反应式为
(4)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛.在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH).与氢化铝锂性质相似但较温和的另一种还原剂由上述a、e、i三种元素组成.该物质受热分解的化学方程式为
(5)前沿化学研究在高能射线作用下产生了一些新型还原剂.当用高能射线照射由a、c元素组成的分子对应的常见液态物质时,该物质分子可按照一种新的方式电离,释放出电子.写出该分子该种方式的电离方程式
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ______ | ______ | ______ | ______ | ||||
| 3 | ______ | ______ | ______ | ______ | ______ | ______ | ||
(3)i在b的氧化物中燃烧的方程式为______.
(4)h和d所形成的化合物的电子式为______.
(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式______.
现有下列短周期元素性质的有关数据:
| 元素编号 | a | b | c | d | e | f | g | H |
| 原子半径 | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高价或最低价 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
(1)根据元素周期律确定a~h八种元素在周期表中的位置,将他们的元素编号填入下表相应的空格内。
| ⅠA族 | ⅡA族 | ⅢA族 | ⅣA族 | ⅤA族 | ⅥA族 | ⅦA族 | 0族 | |
| 第一周期 | ||||||||
| 第二周期 | ||||||||
| 第三周期 | ||||||||
(2)氢化铝锂(LiAlH4)是一种易燃、易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂极易不解,可得三种产物,请写出其水解的反应方程式: 。
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,该还原剂的化学式是: 。
(3)一种离子化合物A由a和c两种元素组成,两元素的原子个数比为5:1,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构。写出A的电子式: 。
A物质与水反应生成一种碱和一种无色气体,写出有关化学方程式:
。该反应中的还原剂为: 。
(4)物质熔沸点的高低与该物质的晶体结构有关。d的单质晶体熔点为2573K,沸点为2823K,硬度大,则属于 晶体。某同学猜想f和b的下周期同主族元素形成的化合物B晶体类型与NaCl相同,则B的熔、沸点应 (填“高于”或“低于”)NaCl。如果用实验证明上述猜想不正确,你的实验方案是 .
查看习题详情和答案>>现有下列短周期元素性质的有关数据:
| 元素编号 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.037 | 0.099 | 0.077 | 0.110 | 0.104 | 0.143 | 0.066 | 0.186 |
| 最高化合价或最低化合价 | +1 | -1 | +4 | +5 | +6 | +3 | -2 | +1 |
根据上表回答下列问题:
(1)单质c不可能具有的性质是 。
A.具有良好的导电性 B.熔沸点很高 C.硬度较小 D.易与单质a反应
(2)写出e与h反应生成物的电子式 。
(3)g与h反应生成一种有强氧化性的物质,写出该物质与水反应的化学方程式
![]() ,该反应的还原剂是(用化学式表示) 。
,该反应的还原剂是(用化学式表示) 。
(4)a与c形成的相对分子质量最小的物质,4g该物质完全燃烧生成稳定的物质时放出222.55kJ热量,写出该反应的热化学方程式
查看习题详情和答案>>| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | a a |
b b |
c c |
j j |
||||
| 3 | h h |
i i |
e e |
g g |
d d |
f f |
||
(3)i在b的氧化物中燃烧的方程式为
| ||
| ||
(4)h和d所形成的化合物的电子式为
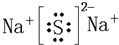
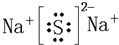
(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式

