摘要:非金属及其化合物
网址:http://m.1010jiajiao.com/timu3_id_374754[举报]
金属及其化合物在生产、生活中有广泛应用.请回答下列问题:
(1)工业上常利用Fe2+能与CN-形成稳定Fe(CN)4-6(六氰合亚铁离子)的特点来处理含CN-的工业废水.
①写出基态Fe2+的电子排布式______.
②从结构角度分析Fe3+较Fe2+稳定的原因______.
③CN-中C原子的杂化轨道类型为______.
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体中存在的微粒间作用力有______.
(3)铁元素为血红蛋白和肌红蛋白的活性部分--血红素的重要组成部分;
①血红素的结构式为:
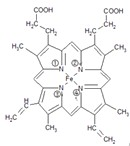
血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是______.铁原子周围哪些氮原子参与形成了配位键______(空格上填氮原子标号).
(4)钙是人体所需的重要元素之一,有一种补钙剂--抗坏血酸钙的组成为Ca(C6H7O6)2?4H2O,其结构示意图如下:
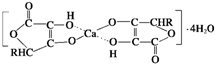
该物质中存在的化学键类型包括______(填字母).
A.金属键B.离子键 C.非极性共价键D.配位键
(5)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是______.
查看习题详情和答案>>
(1)工业上常利用Fe2+能与CN-形成稳定Fe(CN)4-6(六氰合亚铁离子)的特点来处理含CN-的工业废水.
①写出基态Fe2+的电子排布式______.
②从结构角度分析Fe3+较Fe2+稳定的原因______.
③CN-中C原子的杂化轨道类型为______.
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体中存在的微粒间作用力有______.
(3)铁元素为血红蛋白和肌红蛋白的活性部分--血红素的重要组成部分;
①血红素的结构式为:

血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是______.铁原子周围哪些氮原子参与形成了配位键______(空格上填氮原子标号).
(4)钙是人体所需的重要元素之一,有一种补钙剂--抗坏血酸钙的组成为Ca(C6H7O6)2?4H2O,其结构示意图如下:

该物质中存在的化学键类型包括______(填字母).
A.金属键B.离子键 C.非极性共价键D.配位键
(5)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是______.
(1)非金属及其化合物主要是按下列规律存在于自然界的:
气态氢化物 非金属单质 非金属氧化物 含氧酸 盐
请你将硫及其化合物按上述规律写出来
(2)请任意写出四个体现SO2其酸性氧化物化学通性的化学方程式:①
(3)举例写化学方程式或离子方程式:①阴离子被氧化(离子方程式)
查看习题详情和答案>>
气态氢化物 非金属单质 非金属氧化物 含氧酸 盐
请你将硫及其化合物按上述规律写出来
H2S→S→SO2→H2SO3→Na2SO3或H2S→S→SO2→SO3→H2SO4→Na2SO4
H2S→S→SO2→H2SO3→Na2SO3或H2S→S→SO2→SO3→H2SO4→Na2SO4
.(2)请任意写出四个体现SO2其酸性氧化物化学通性的化学方程式:①
SO2+H2O H2SO3
H2SO3
 H2SO3
H2SO3SO2+H2O H2SO3
H2SO3
;② H2SO3
H2SO3SO2+CaO=CaSO3
SO2+CaO=CaSO3
;③SO2+2NaOH=Na2SO3+H2O
SO2+2NaOH=Na2SO3+H2O
;④SO2+Na2CO3=Na2SO3+CO2↑
SO2+Na2CO3=Na2SO3+CO2↑
.(3)举例写化学方程式或离子方程式:①阴离子被氧化(离子方程式)
2I-+Cl2=2Cl-+I2
2I-+Cl2=2Cl-+I2
;②Fe3O4是氧化产物3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||