题目内容
(1)非金属及其化合物主要是按下列规律存在于自然界的:气态氢化物 非金属单质 非金属氧化物 含氧酸 盐
请你将硫及其化合物按上述规律写出来______.
(2)请任意写出四个体现SO2其酸性氧化物化学通性的化学方程式:①______;②______;③______;④______.
(3)举例写化学方程式或离子方程式:①阴离子被氧化(离子方程式)______;②Fe3O4是氧化产物______ Fe3O4
【答案】分析:(1)根据硫元素的单质及化合物的存在形成分析;
(2)酸性氧化物能与水、碱、碱性氧化物以及盐发生反应;
(3)根据常见物质的性质分析.
解答:解:(1)S对应的氢化物为H2S,单质为S,氧化物有SO2或SO,对应的含氧酸有H2SO3或H2SO4,
盐有Na2SO3或Na2SO4等,
故答案为:H2S→S→SO2→H2SO3→Na2SO3或H2S→S→SO2→SO3→H2SO4→Na2SO4;
(2)酸性氧化物能与水、碱、碱性氧化物以及盐发生反应,则反应的方程式有SO2+H2O H2SO3、
H2SO3、
SO2+CaO=CaSO3、SO2+2NaOH=Na2SO3+H2O、以及SO2+Na2CO3=Na2SO3+CO2↑都能表现的酸性氧化物的性质,
故答案为:①SO2+H2O H2SO3; ②SO2+CaO=CaSO3;③SO2+2NaOH=Na2SO3+H2O;
H2SO3; ②SO2+CaO=CaSO3;③SO2+2NaOH=Na2SO3+H2O;
④SO2+Na2CO3=Na2SO3+CO2↑;
(3)①I-、S2-、SO32-等离子都具有还原性,在一定条件下能被合适的氧化剂氧化,如2I-+Cl2=2Cl-+I2,
故答案为:2I-+Cl2=2Cl-+I2;
②Fe能被O或H2O氧化生成Fe3O4,如3Fe+2O2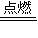 Fe3O4,
Fe3O4,
故答案为:3Fe+2O2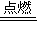 Fe3O4;
Fe3O4;
点评:本题考查常见含硫物质的性质,题目难度不大,注意相关基础知识的积累.
(2)酸性氧化物能与水、碱、碱性氧化物以及盐发生反应;
(3)根据常见物质的性质分析.
解答:解:(1)S对应的氢化物为H2S,单质为S,氧化物有SO2或SO,对应的含氧酸有H2SO3或H2SO4,
盐有Na2SO3或Na2SO4等,
故答案为:H2S→S→SO2→H2SO3→Na2SO3或H2S→S→SO2→SO3→H2SO4→Na2SO4;
(2)酸性氧化物能与水、碱、碱性氧化物以及盐发生反应,则反应的方程式有SO2+H2O
 H2SO3、
H2SO3、SO2+CaO=CaSO3、SO2+2NaOH=Na2SO3+H2O、以及SO2+Na2CO3=Na2SO3+CO2↑都能表现的酸性氧化物的性质,
故答案为:①SO2+H2O
 H2SO3; ②SO2+CaO=CaSO3;③SO2+2NaOH=Na2SO3+H2O;
H2SO3; ②SO2+CaO=CaSO3;③SO2+2NaOH=Na2SO3+H2O;④SO2+Na2CO3=Na2SO3+CO2↑;
(3)①I-、S2-、SO32-等离子都具有还原性,在一定条件下能被合适的氧化剂氧化,如2I-+Cl2=2Cl-+I2,
故答案为:2I-+Cl2=2Cl-+I2;
②Fe能被O或H2O氧化生成Fe3O4,如3Fe+2O2
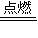 Fe3O4,
Fe3O4,故答案为:3Fe+2O2
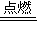 Fe3O4;
Fe3O4;点评:本题考查常见含硫物质的性质,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


 ”代表未成键价电子,短线代表一个化学键。
”代表未成键价电子,短线代表一个化学键。