摘要: ⑴ 0.03 mol/ ⑵①平衡 ,大于 . ② d . a .
网址:http://m.1010jiajiao.com/timu3_id_374527[举报]
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如下图.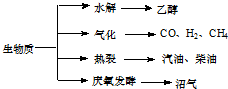
(1)下列有关说法正确的是 .
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇属生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等发酵获得的沼气,主要成是甲烷
(2)由生物质能获得的CO和H2,当两者1:1催化反应,其原子利用率达100%,合成的物质可能是 .
a.汽油 b.甲醇c.甲醛 d.乙酸
(3)已知在生物质气化炉中可发生:
C(s)+CO2(g)=2CO(g)△H=172kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=206kJ/mol
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=165kJ/mol
则:C(s)+H2O(g)=CO(g)+H2(g)△H= kJ/mol.
(4)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
反应:CO(g)+H2O(g)?CO2(g)+H2(g),该反应的△H 0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)= .
查看习题详情和答案>>

(1)下列有关说法正确的是
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇属生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等发酵获得的沼气,主要成是甲烷
(2)由生物质能获得的CO和H2,当两者1:1催化反应,其原子利用率达100%,合成的物质可能是
a.汽油 b.甲醇c.甲醛 d.乙酸
(3)已知在生物质气化炉中可发生:
C(s)+CO2(g)=2CO(g)△H=172kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=206kJ/mol
CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=165kJ/mol
则:C(s)+H2O(g)=CO(g)+H2(g)△H=
(4)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
 目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)(1)钢是含碳量为0.03%~2%的
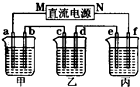
(2)如图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
①上述装置中M极为直流电源的
②若在钢币上镀铜,应选择
(3)工业上以铝土矿(主要成分Al2O3?nH2O,含少量的氧化铁和石英等杂质)为原料生产铝.为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式
(4)已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al.1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约
 某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(a)取碱式滴定管;(b)用蒸馏水洗净;(c)即加入NaOH标准溶液;(d)记录液面刻度读数;(e)用酸式滴定管精确放出一定量待测盐酸溶液于只用蒸馏水洗涤过的锥形瓶中;(f)向锥形瓶中加入适量蒸馏水;(g)加入酚酞试液2滴;(h)滴定时边摇荡锥形瓶;(i)边注视滴定管内液面变化;(j)当滴到溶液由无色恰好变为粉红色时,立即停止滴定;(k)记录液面刻度读数;(m)重复两次滴定并记录读数
(1)上述实验过程中错误之处有(用序号字母填写)
cij
cij
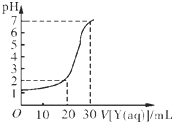
(2)如下图所示,某同学绘制了用标准NaOH溶液(Y)滴定10.00mL待测盐酸溶液(X)过程中的滴定曲线,依据图象推出X和Y的物质的量浓度是下表中的
A
A
.| A | B | C | D | |
| X/mol?L-1 | 0.09 | 0.03 | 0.9 | 0.3 |
| Y/mol?L-1 | 0.03 | 0.09 | 0.3 | 0.9 |
ADE
ADE
.A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
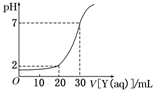 如图为对15mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,根据图象推出X(mol/L)和Y(mol/L)的物质的量浓度是下表内各组中的( ) 如图为对15mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,根据图象推出X(mol/L)和Y(mol/L)的物质的量浓度是下表内各组中的( )
|
查看习题详情和答案>>
 煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.(1)①右图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为
②已知:H2(g)、CO(g)和CH3CH2OH(l)的燃烧热分别为285.8kJ?mol-1、283.0kJ?mol-1和1365.5kJ?mol-1.
反应2CO(g)+4H2(g)?CH3CH2OH(l)+H2O(l) 的△H=
(2)煤气化所得气体可用于工业合成二甲醚,其反应如下:
2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)
同时发生副反应:CO(g)+2H2(g)?CH3OH(g)、CO(g)+H2O(g)?CO2(g)+H2(g).
在温度250℃、压强3.0MPa时,某工厂按投料比V(H2):V(CO)=a进行生产,平衡时反应体系中各组分体积分数如下表:
| 物质 | H2 | CO | CO2 | (CH3)2O | CH3OH | H2O |
| 体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
②投料比a=
③该工厂用100吨煤(含炭80%、气化为CO的利用率为90%)在该条件下可生产多少吨二甲醚?(写出计算过程)