题目内容
 某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(a)取碱式滴定管;(b)用蒸馏水洗净;(c)即加入NaOH标准溶液;(d)记录液面刻度读数;(e)用酸式滴定管精确放出一定量待测盐酸溶液于只用蒸馏水洗涤过的锥形瓶中;(f)向锥形瓶中加入适量蒸馏水;(g)加入酚酞试液2滴;(h)滴定时边摇荡锥形瓶;(i)边注视滴定管内液面变化;(j)当滴到溶液由无色恰好变为粉红色时,立即停止滴定;(k)记录液面刻度读数;(m)重复两次滴定并记录读数
(1)上述实验过程中错误之处有(用序号字母填写)
cij
cij
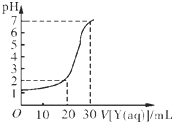
(2)如下图所示,某同学绘制了用标准NaOH溶液(Y)滴定10.00mL待测盐酸溶液(X)过程中的滴定曲线,依据图象推出X和Y的物质的量浓度是下表中的
A
A
.| A | B | C | D | |
| X/mol?L-1 | 0.09 | 0.03 | 0.9 | 0.3 |
| Y/mol?L-1 | 0.03 | 0.09 | 0.3 | 0.9 |
ADE
ADE
.A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
分析:(1)滴定管在装液前要进行润洗;滴定时眼睛注视锥形瓶中溶液颜色的变化;溶液由无色恰好变为粉红色时,且30s不复色;
(2)设标准NaOH溶液、待测盐酸的浓度,然后根据滴定曲线立方程式组来求解;
(3)根据c(待测)=
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(2)设标准NaOH溶液、待测盐酸的浓度,然后根据滴定曲线立方程式组来求解;
(3)根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
解答:解:(1)滴定管在装液前要进行润洗,所以c错;滴定时眼睛注视锥形瓶中溶液颜色的变化,所以i错;溶液由无色恰好变为粉红色时,且30s不复色,所以j错,故选:A.
(2)设标准NaOH溶液、待测盐酸的浓度分别为Y mol/L,X mol/L;
标准NaOH溶液滴入的体积为20mL时有:10.00mL×Xmol/L-20mL×Y mol/L=30.00mL×10-2mol/L;
标准NaOH溶液滴入的体积为30mL时有:10.00mL×Xmol/L=30mL×Ymol/L;
X=0.09
Y=0.03
故选:A.
(3)A.以酚酞为指示剂时等质量的氢氧化钠和Na2CO3消耗的酸前者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(标准)偏大,根据c(待测)=
,可知c(标准)偏大,故A正确;
B.滴定终点读数时,俯视滴定管的刻度,造成V(标准)偏小,根据c(待测)=
,可知c(标准)偏小,故B错误;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
,可知c(标准)不变,故C错误;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标准)偏大,根据c(待测)=
,可知c(标准)偏大,故D正确;
E.未用标准液润洗碱式滴定管,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
,可知c(标准)偏大,故E正确;
故选:ADE.
(2)设标准NaOH溶液、待测盐酸的浓度分别为Y mol/L,X mol/L;
标准NaOH溶液滴入的体积为20mL时有:10.00mL×Xmol/L-20mL×Y mol/L=30.00mL×10-2mol/L;
标准NaOH溶液滴入的体积为30mL时有:10.00mL×Xmol/L=30mL×Ymol/L;
X=0.09
Y=0.03
故选:A.
(3)A.以酚酞为指示剂时等质量的氢氧化钠和Na2CO3消耗的酸前者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
B.滴定终点读数时,俯视滴定管的刻度,造成V(标准)偏小,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
E.未用标准液润洗碱式滴定管,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
故选:ADE.
点评:本题主要考查了滴定操作、误差分析以及根据滴定曲线进行化学计算,难度不大,根据课本知识即可完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(a)取碱式滴定管;(b)用蒸馏水洗净;(c)即加入NaOH标准溶液;(d)记录液面刻度读数;(e)用酸式滴定管精确放出一定量待测盐酸溶液于只用蒸馏水洗涤过的锥形瓶中;(f)向锥形瓶中加入适量蒸馏水;(g)加入酚酞试液2滴;(h)滴定时边摇荡锥形瓶;(i)边注视滴定管内液面变化;(j)当滴到溶液由无色恰好变为粉红色时,立即停止滴定;(k)记录液面刻度读数;(m)重复两次滴定并记录读数
(1)上述实验过程中错误之处有(用序号字母填写)______
(2)如下图所示,某同学绘制了用标准NaOH溶液(Y)滴定10.00mL待测盐酸溶液(X)过程中的滴定曲线,依据图象推出X和Y的物质的量浓度是下表中的______.
(3)在实验中可能造成测定结果偏高的原因是______.
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
(a)取碱式滴定管;(b)用蒸馏水洗净;(c)即加入NaOH标准溶液;(d)记录液面刻度读数;(e)用酸式滴定管精确放出一定量待测盐酸溶液于只用蒸馏水洗涤过的锥形瓶中;(f)向锥形瓶中加入适量蒸馏水;(g)加入酚酞试液2滴;(h)滴定时边摇荡锥形瓶;(i)边注视滴定管内液面变化;(j)当滴到溶液由无色恰好变为粉红色时,立即停止滴定;(k)记录液面刻度读数;(m)重复两次滴定并记录读数
(1)上述实验过程中错误之处有(用序号字母填写)______
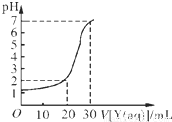
(2)如下图所示,某同学绘制了用标准NaOH溶液(Y)滴定10.00mL待测盐酸溶液(X)过程中的滴定曲线,依据图象推出X和Y的物质的量浓度是下表中的______.
| A | B | C | D | |
| X/mol?L-1 | 0.09 | 0.03 | 0.9 | 0.3 |
| Y/mol?L-1 | 0.03 | 0.09 | 0.3 | 0.9 |
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.

