��Ŀ����
��1�������й�˵����ȷ����
a���������ܣ�������������Դ��̫����
b������ά��ˮ���õ��Ҵ�����������
c���������ѽ��õ����͡����͵����ڴ�����
d����ֲ��ո˵ȷ��ͻ�õ���������Ҫ���Ǽ���
��2�����������ܻ�õ�CO��H2��������1��1����Ӧ����ԭ�������ʴ�100%���ϳɵ����ʿ�����
a������ b���״�c����ȩ d������
��3����֪������������¯�пɷ�����
C��s��+CO2��g��=2CO��g����H=172kJ/mol
CH4��g��+H2O��g��=CO��g��+3H2��g����H=206kJ/mol
CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=165kJ/mol
��C��s��+H2O��g��=CO��g��+H2��g����H=
��4����֪̼��������Ӧ�ڲ�ͬ�¶���ƽ�ⳣ���Ķ���ֵ��lgK�����±���
| ������Ӧʽ | lgK | ||
| 700K | 900K | 1200K | |
| C��s��+H2O��g��=CO��g��+H2��g�� | -2.64 | -0.39 | 1.58 |
| C��s��+2H2O��g��=CO2��g��+2H2��g�� | -1.67 | -0.03 | 1.44 |
B���Ҵ���Դ����ά�أ�
C���������ָ�ɶ���������ɵ����ʣ�
d��������Ҫ���Ǽ��飻
��2�����������غ㶨�ɺͻ��Ϸ�Ӧ�Ķ�����ص��жϣ���Ҫ�����÷�Ӧǰ��ԭ�ӵ�����䣬����Ŀ�ر��ֲ�������жϣ�
��3�����ø�˹���ɣ�����+��-�ڿɵá�H��
��4���ӱ������ݿ������¶ȵ����ߣ�ƽ�ⳣ���Ķ���ֵ����ƽ�ⳣ��Ҳ����Ȼ�����ø�˹���ɽ��⣮
b���Ҵ����������ܣ���b��ȷ��
c�����͡����͵����ڻ�����c����
d��������Ҫ���Ǽ��飬��d��ȷ��
�ʴ�Ϊ��abd��
��2������ɫ��ѧ����ʵ�����ŷţ�����Ӧ���е�ԭ�������ʴﵽ100%��Ҳ����˵��Ӧ����һ���ǻ��Ϸ�Ӧ���ҷ�Ӧ������еĸ�ԭ����Ŀ�Ȳ��䣬CO��H2��һ�������°��ղ�ͬ�ı�����Ӧ���ɼٶ���Ӧʱ�Ļ�ѧ������֮��Ϊ1��1����ֻҪ��ѡ���еĻ�ѧʽ�ܻ�Ϊ��ʽ��CO��n��H2��n��������ȷ�ģ������ǻ����״���CH4O���ɱ�Ϊ��CO��1��H2��2����ȩ��CH2O���ɱ�Ϊ��CO��1��H2��1�����ᣨC2H4O2���ɱ�Ϊ��CO��2��H2��2��
�ʴ�Ϊ��cd��
��3����֪����C��s��+CO2��g��=2CO��g����H=172kJ/mol
��CH4��g��+H2O��g��=CO��g��+3H2��g����H=206kJ/mol
��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=165kJ/mol
Ϊ��C��s��+H2O��g��=CO��g��+H2��g������H1�ķ�Ӧ�ȣ����ø�˹���ɽ���+��-�ڿɵã�
��H=172kJ/mol+165kJ/mol-206kJ/mol=+131kJ/mol��
�ʴ�Ϊ��+131��
��4���ӱ������ݿ������¶ȵ����ߣ�ƽ�ⳣ���Ķ���ֵ����ƽ�ⳣ��Ҳ����˵����Ϊ���ȷ�Ӧ�����е�2������ʽ��ȥ��1������ʽ�ɵ÷���ʽCO��g��+H2O��g��?CO2��g��+H2��g������Ӧ�ص�2������ʽ��ƽ�ⳣ�����Ե�1������ʽ��ƽ�ⳣ���ø÷�Ӧ��ƽ�ⳣ�������������ӦΪ-0.03-��-0.39��=0.36���ʴ�Ϊ������0.36��

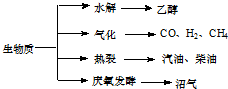
(15��)��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ��������ͼ��
��1�������й�˵����ȷ���� �� ��
a���������ܣ�������������Դ��̫����
b������ά��ˮ���õ��Ҵ���ȼ������������������
c���������ѽ��õ����͡����͵����ڴ�����
d����ֲ��ո˵��������ͻ�õ���������Ҫ�ɷ��Ǽ���
��2�����������ܻ�õ�CO��H2�����Ժϳɼ״��Ͷ����ѣ�CH3OCH3���������������ʡ�������1��1����Ӧ����ԭ�������ʴ�100%���ϳɵ����ʿ����� ��
a������ b���״� c����ȩ d������
��3���״���һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ϻϳɼ״��ķ�Ӧ��
CO(g)��2H2(g) CH3OH(g) ��H= -90.8kJ��mol-1��
CH3OH(g) ��H= -90.8kJ��mol-1��
�����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
|
���� |
�� |
�� |
�� |
|
��Ӧ��Ͷ���� |
1molCO ��2molH2 |
1mol CH3OH |
2molCO��4molH2 |
|
CH3OH��Ũ�ȣ�mol/L�� |
c1 |
c2 |
c3 |
|
��Ӧ�������仯 |
�ų�Q1 kJ |
����Q2 kJ |
�ų�Q3 kJ |
|
ƽ�ⳣ�� |
K1 |
K2 |
K3 |
|
��Ӧ��ת���� |
�� 1 |
�� 2 |
�� 3 |
����˵����ȷ���� ��
a. c1 = c2 b. 2Q1 �� Q3 c. K1=K3 d. ��2+ ��3�� 100%
��4����һ���¶Ⱥ�ѹǿ�£�CO��H2���ϳɶ����ѵķ�ӦΪ��
3H2��g��+3CO��g��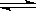 CH3OCH3��g��+CO2��g��
CH3OCH3��g��+CO2��g��
����һ����ɱ���ܱ������г���3 mol H2��3 mol CO��1 mol CH3OCH3��1 mol CO2����һ��ʱ��ﵽƽ�⣬�����ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6�����ٷ�Ӧ��ʼʱ�����淴Ӧ���ʵĴ�С��v(����____v(��)��� >������ < ����=������������
��ƽ��ʱn(CH3OCH3)= mol��
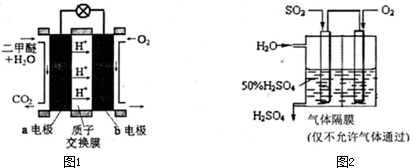
����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��
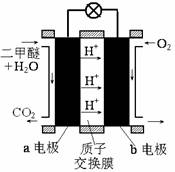
b�缫�� ����a�缫�ķ�ӦʽΪ ��
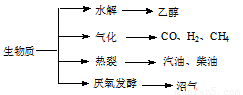
 ��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ������ͼ��
��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ������ͼ��