摘要:35.(选修---现代生物科技专题) 已知SARS是由一种RNA病毒感染所引起的疾病.SARS病毒表面的S蛋白是主要的病毒抗原.在SARS病人康复后的血清中有抗S蛋白的特异性抗体.某研究小组为了研制预防SARS病毒的疫苗.开展了前期研究工作.其简要的操作流程如下: (1)实验步骤①所代表的反应过程是 . (2)步骤②构建重组表达载体A和重组表达载体B必须使用限制性内切酶和 酶. (3)如果省略步骤②而将大量扩增的S基因直接导入大肠杆菌.一般情况下.不能得到表达的S蛋白.其原因是S基因在大肠杆菌中不能 .也不能 . (4)为了检验步骤④所表达的S蛋白是否与病毒S蛋白有相同的免疫反应特性.可用 与 进行抗原-抗体特异性反应实验.从而得出结论. (5)步骤④和⑥的结果相比.原核细胞表达的S蛋白与真核细胞表达的S蛋白的氨基酸序列 .根本原因是 . 36. [物理--选修3-3] 如图所示.气缸放置在水平平台上.活塞质量为10 kg.横截面积50 cm2.厚度1 cm.气缸全长 21 cm.气缸质量20kg大气压强为l×105 Pa.当温度为7℃时.活塞封闭的气柱长10 cm.若将气缸倒过来放置时.活塞下方的空气能通过平台上的缺口与大气相通.g取10 m/s2求: (1)气柱多长? (2)当温度多高时.活塞刚好接触平台?
网址:http://m.1010jiajiao.com/timu3_id_374011[举报]
(2013?兰州一模)[化学--选修5 有机化学基础]
化学的发展对人类的健康生活起到了很好的保障作用,如图是合成具有降血脂、胆固醇作用的药物冠心平F的一条合成路线:(注:R表示烃基或H原子)
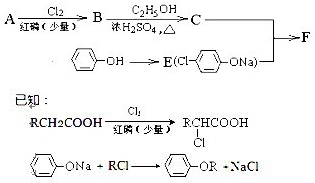
(1)通过质谱法测得A的相对分子质量为88,8.8g A在足量的氧气中完全燃烧生成17.6g CO2,生成7.2g水,则A的分子式为
 .
.
(2)判断符合A分子式且符合下列特征反应的同分异构体有
①能与活泼金属钠反应 ②能与银氨溶液发生银镜反应
(3)写出B→C反应方程式: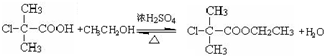
 .
.
(4)写出F的结构简式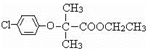
 ,F不能发生反应的有
,F不能发生反应的有
①加成反应 ②酯化反应 ③加聚反应 ④水解反应 ⑤消去反应 ⑥取代反应.
查看习题详情和答案>>
化学的发展对人类的健康生活起到了很好的保障作用,如图是合成具有降血脂、胆固醇作用的药物冠心平F的一条合成路线:(注:R表示烃基或H原子)

(1)通过质谱法测得A的相对分子质量为88,8.8g A在足量的氧气中完全燃烧生成17.6g CO2,生成7.2g水,则A的分子式为
C4H8O2
C4H8O2
.若A的核磁共振氢谱有三种峰,且峰面积之比为6:1:1,结合流程信息推断,A的结构简式为

(2)判断符合A分子式且符合下列特征反应的同分异构体有
5
5
种.①能与活泼金属钠反应 ②能与银氨溶液发生银镜反应
(3)写出B→C反应方程式:


(4)写出F的结构简式


②③⑤
②③⑤
(填编号).①加成反应 ②酯化反应 ③加聚反应 ④水解反应 ⑤消去反应 ⑥取代反应.
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.A.[物质结构]
[Cu(NH3)4]SO4?H2O是一种杀虫剂.
(1)Cu元素基态原子的电子排布式为
(2)元素N、O、S的第一电离能由大到小排列的顺序为
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为
(5)与S
| O | 2- 4 |
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为
B.[实验化学]
目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇酯,简称聚酯)制作的.利用废聚酯饮料瓶制备对苯二甲酸的反应原理如下:
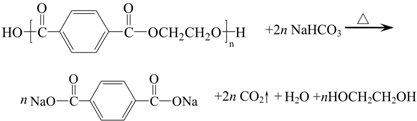
实验过程如下:
步骤1:在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计.依次加入5g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇.缓慢搅拌,油浴加热,升温至180℃,反应15分钟.
步骤2:冷却至160℃停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏.
步骤3:向四颈瓶中加入50mL沸水,搅拌使残留物溶解.抽滤除去少量不溶物.
步骤4:将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL,加入沸石,将烧杯置于石棉网上加热煮沸.
步骤5:取下烧杯,取出沸石后趁热边搅拌边用8~10mL 1:1HCl酸化,酸化结束,体系呈白色浆糊状.
步骤6:冷至室温后再用冰水冷却.抽滤,滤饼用蒸馏水洗涤数次至滤出液pH=6,抽干后再用10mL丙酮分2次洗涤,抽干,干燥.
(1)步骤1反应过程中的现象是
(2)步骤2是为了分离出
(3)步骤3抽滤需要用到的主要仪器有
(4)步骤4加沸石的目的是
(5)步骤5用盐酸酸化的目的是
(6)步骤6用丙酮洗涤的目的是
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: 化合物b中进行sp
化合物b中进行sp 3杂化的原子有: .
3杂化的原子有: .
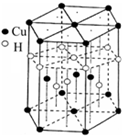
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是: (选填序号:a.氯化钠 b.氯化铯 c.石英 d.金刚石).
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为: .
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为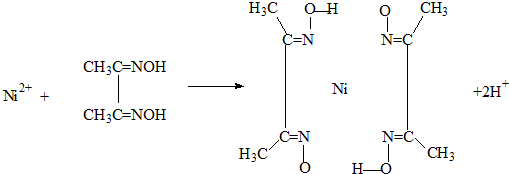
B.4-氯苯胺是合成橡胶、化学试剂、染料、色素等化工产品,制备4-氯苯胺的原理如下:
 .在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
(1)开始时先通入N2的目的是 .
(2)上述实验中过滤的目的是 ,洗涤所用的试剂是 .
(3)蒸馏时除用到接引管、锥形瓶、温度计外,还用到的玻璃仪器有: 、 .馏出液的主要成分是 .
(4)以下是温度、氢气压力、催化剂用量及吗啉的用量对反应的影响.
优化的条件是:温度、氢气压力、催化剂用量、吗啉用量,选择的序号依次是 .
查看习题详情和答案>>
A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al
(2)雷尼镍催化的一实例为:
 化合物b中进行sp
化合物b中进行sp 3杂化的原子有:
3杂化的原子有:(3)一种铝镍合金的结构如下图,与其结构相似的化合物是:
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为:
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为

B.4-氯苯胺是合成橡胶、化学试剂、染料、色素等化工产品,制备4-氯苯胺的原理如下:
 .在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.(1)开始时先通入N2的目的是
(2)上述实验中过滤的目的是
(3)蒸馏时除用到接引管、锥形瓶、温度计外,还用到的玻璃仪器有:
(4)以下是温度、氢气压力、催化剂用量及吗啉的用量对反应的影响.
| 表1温度 | 表2氢气压力 | 表3催化剂用量 | 表4吗啉用量 | |||||||||||||||
| 序号 | 温度/℃ | 转化率/% | 选择 性/% |
反应时间/h | 序号 | 氢气压力/MPa | 选择性/% | 反应时间/h | 序号 | 雷尼镍用量/g | 选择性/% | 反应时间/h | 序号 | 吗啉用量/% | 选择性/% | |||
| ① | 40 | 未完全 | 99.6 | 6 | ① | 0.5 | 99.6 | 3.7 | ① | 2 | 98.25 | 5 | ① | 0.0 | 84.3 | |||
| ② | 60 | 100 | 99.7 | 4 | ② | 1.0 | 99.7 | 2 | ② | 4 | 99.20 | 2.2 | ② | 0.3 | 99.3 | |||
| ③ | 80 | 100 | 99.6 | 2.45 | ③ | 1.5 | 99.2 | 1.6 | ③ | 6 | 99.60 | 1.9 | ③ | 0.5 | 99.7 | |||
| ④ | 100 | 100 | 99.6 | 2 | ④ | 2.0 | 96.4 | 1.15 | ④ | 8 | 99.60 | 1.4 | ④ | 0.7 | 99.6 | |||
| ⑤ | 120 | 100 | 98.6 | 1.7 | ⑤ | ⑤ | 10 | 99.10 | 1.4 | ⑤ | 1.2 | 99.7 | ||||||
【化学--选修5有机化学基础】
I.物质A为生活中常见的有机物,只含有C、H、O三种元素,已知该有机物的蒸气密度是相同条件下H密度的23倍,其中氧元素的质量分数为34.8%,且有如下的转化关系:
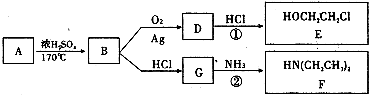
(1)由A→B的反应类型是 .
(2)D的红外光谱表明分子内除C-H键、C-C键外还含有两个C-O单键,反应①中D与HCl按物质的量之比1:l反应,原子利用率为100%,则D的结构简式是 .
II.化合物E和F是药品普鲁卡因合成的重要原料.普鲁卡因的合成路线如下:
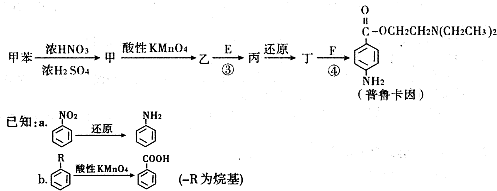
(3)由甲苯生成物质甲的化学方程式为 .
(4)丁的结构简式为 .
(5)反应③的化学方程式是 .
(6)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式.符合下列条件的戊的同分异构体有 种(包含戊).
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构.中一定含官能团-NH2,且-NH2直接与碳原子相连
(7)戊经聚合反应可制成的高分子纤维广泛用于通讯、宇航等领域.该聚合反应的化学方程式是 .
查看习题详情和答案>>
I.物质A为生活中常见的有机物,只含有C、H、O三种元素,已知该有机物的蒸气密度是相同条件下H密度的23倍,其中氧元素的质量分数为34.8%,且有如下的转化关系:

(1)由A→B的反应类型是
(2)D的红外光谱表明分子内除C-H键、C-C键外还含有两个C-O单键,反应①中D与HCl按物质的量之比1:l反应,原子利用率为100%,则D的结构简式是
II.化合物E和F是药品普鲁卡因合成的重要原料.普鲁卡因的合成路线如下:

(3)由甲苯生成物质甲的化学方程式为
(4)丁的结构简式为
(5)反应③的化学方程式是
(6)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式.符合下列条件的戊的同分异构体有
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构.中一定含官能团-NH2,且-NH2直接与碳原子相连
(7)戊经聚合反应可制成的高分子纤维广泛用于通讯、宇航等领域.该聚合反应的化学方程式是
[化学──选修物质结构与性质]
图表法、图象法是常用的科学研究方法.下表列出前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号).比元素B原子序数大10的元素在元素周期表中的位置: 周期, 族,其基态原子的核外电子排布是 .
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 .
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成 个σ键, 个π键.
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第 族.

图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第 族元素氢化物的沸点的变化规律.不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线-折线a和折线b,你认为正确的是 ,理由是 .
查看习题详情和答案>>
图表法、图象法是常用的科学研究方法.下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素中第一电离能最小的是:
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第

图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第