网址:http://m.1010jiajiao.com/timu3_id_373534[举报]
①根据上述实验,写出SOCl2与水反应的化学方式
②AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3?6H2O混合共热,可得无水AlCl3,其原因是
(2)将足量AgCl分别溶于下列试剂中形成AgCl饱和溶液,沉淀溶解平衡表示式为:
AgCl (s)?Ag+(aq)+Cl-(aq),AgCl的Ksp=1.76×10-10 mol2?L-2
①5ml水 ②10ml0.2 mol?L-1MgCl2 ③20ml0.5mol?L-1NaCl
④40ml0.1mol?L-1AlCl3⑤20ml0.3mol?L-1AgNO3溶解至饱和,各溶液中Ag+浓度由大到小的顺序是
(3)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性、向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
| a |
| 200b |
| a |
| 200b |
(4)取等体积的0.10mol/L的NaOH溶液两份.取一份敞放在空气中一段时间后,得溶液A.另一份B密封保存.则A、B两份溶液的pH值是否相同
①若用甲基橙为指示剂时,VA与VB的关系是
②若用酚酞为指示剂时,VA与VB的关系是
Mg(OH)2(s) ![]() Mg2++2OH- ①
Mg2++2OH- ①
NH![]() +H2O
+H2O![]() NH3·H2O+H+ ②
NH3·H2O+H+ ②
H++OH-![]() H2O ③
H2O ③
由于NH![]() 水解呈酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解。
水解呈酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2(s) ![]() Mg2++2OH- ①
Mg2++2OH- ①
NH![]() +OH-
+OH-![]() NH3·H2O ②
NH3·H2O ②
由于NH![]() 电离出的NH
电离出的NH![]() 与Mg(OH)2电离出的OH-结合生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
与Mg(OH)2电离出的OH-结合生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确。你认为他选用的试剂是_________(填编号)。
A.NH4NO3 B.CH3COONH4
C.Na2CO3
D.NH3·H2O
(2)请你说明丙同学作出该选择的理由是___________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解,由此推知,甲、乙哪位同学的解释更合理?_________(填甲或乙)。试写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式:__________。
查看习题详情和答案>>(1)已知:O2 (g)= O2+ (g)+e- △H1= +1175.7 kJ·mol-1
PtF6(g)+ e-= PtF6-(g)???? △H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g)?? △H3=+482.2 kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H=_____ kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:

① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是??????? 。
a.体系的压强保持不变?? ???? b.混合气体的密度保持不变
c.N2和H2的体积比为1:3????? d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3)??? vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA ??? kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为????? %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因???????????????????????? ?????????? (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为?????????? mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
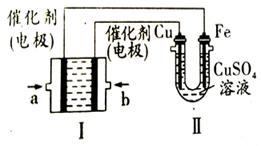
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH ???? (填“变大”、“变小”或“不变”),a极电极反应方程式为????????????????? ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷????? L(标准状况下)。

查看习题详情和答案>>
(1)已知:O2 (g)= O2+ (g)+e- △H1=" +1175.7" kJ·mol-1
PtF6(g)+ e-= PtF6-(g) △H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g) △H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:
① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系的压强保持不变 b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为 %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因 (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为 mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为 ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
PtF6(g)+ e-= PtF6-(g) △H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g) △H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:

① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系的压强保持不变 b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为 %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因 (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为 mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为 ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。