摘要:11]P+[ 15 ]CuSO4+[ 24 ]H2O===[ 5 ]Cu3P+[ 6 ]]H3PO4+[ 15 ]H2SO4 其中氧化剂是 P.CuSO4 .若有1molCuSO4参加反应.则它氧化的P的物质的量是 0.2mol . ⑶配平下列反应的离子方程式:
网址:http://m.1010jiajiao.com/timu3_id_371971[举报]
|
对于白磷引起的中毒,硫酸铜溶液是一处解毒剂,有关反应如下∶11 P+15 CuSO4+24 H2O====5Cu3P|6 H3PO4 +15 H2SO4下列关于该反应的说法正确的是 | |
| [ ] | |
A. |
CuSO4发生了氧化反应 |
B. |
生成1 mol H3PO4时,有10 mol电子转移 |
C. |
氧化产物和还原产物的物质的量之比6∶5 |
D. |
白磷只作还原剂 |
下表为长式周期表的一部分,其中的编号代表对应的元素.
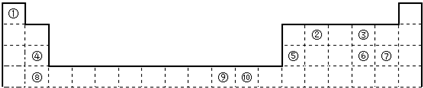
请回答下列问题:
(1)表中属于S区的元素是
(2)写由上述元素组成的分子中电子总数为10,其VSEPR模型与分子立体构型不一致的分子的分子式:
(3)元素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,常把该物质作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.属于含有极性键的极性分子
B.含有4个sp-s的σ键和1个p-p的π键
C.该分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的分子的电子式为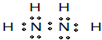
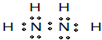 ;
;
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的非金属元素是
查看习题详情和答案>>

请回答下列问题:
(1)表中属于S区的元素是
①④⑧
①④⑧
(填编号).(2)写由上述元素组成的分子中电子总数为10,其VSEPR模型与分子立体构型不一致的分子的分子式:
NH3、H2O
NH3、H2O
.(3)元素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,常把该物质作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
C
C
.A.属于含有极性键的极性分子
B.含有4个sp-s的σ键和1个p-p的π键
C.该分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的分子的电子式为
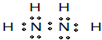
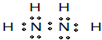
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电子能I(Ev) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
ABC
ABC
(填字母);若E、F为原子序数依次增大的同周期相邻元素,表中显示E比F的第一电离能略大,其原因是Mg的3s轨道上的电子全充满,能量比Al低,自身更稳定,所以第一电离能比Al大
Mg的3s轨道上的电子全充满,能量比Al低,自身更稳定,所以第一电离能比Al大
.Ⅰ.下列有关实验操作中,合理的是
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
E.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是
(2)图1是酸式滴定管中液面在滴定前后的读数:c (NaOH)=
mol/L.

(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度
III.如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用
查看习题详情和答案>>
C
C
(填序号).A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
E.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是
用标准盐酸润洗2-3次
用标准盐酸润洗2-3次
.(2)图1是酸式滴定管中液面在滴定前后的读数:c (NaOH)=
| a(V2-V1) |
| V |
| a(V2-V1) |
| V |

(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度
偏大
偏大
.(选“偏大”“偏小”“不变”)III.如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用
NaOH
NaOH
溶液滴定HCl
HCl
溶液;曲线b是用HCl
HCl
溶液滴定NaOH
NaOH
溶液;P点的坐标为(15,7)
(15,7)
;盐酸的物质的量浓度为0.1
0.1
mol/L.合成氨对化学工业和国防工业具有重要意义.
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图.

①图A中氨气的体积分数为15%时,H2的转化率为
②图B中T=450℃,则温度为500℃时对应的曲线是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
①分析表中数据,判断5min时反应是否处于平衡状态?
②该温度下,上述反应的平衡常数K=
③反应在7~10min内,CO的物质的量减少的原因可能是
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在图C所示坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线.
查看习题详情和答案>>
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图.

①图A中氨气的体积分数为15%时,H2的转化率为
24.46%
24.46%
.②图B中T=450℃,则温度为500℃时对应的曲线是
a
a
(填“a”或“b”).(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
是
是
(填“是”或“否”),前5min反应的平均反应速率v(CH4)=0.02mol?L-1?min-1
0.02mol?L-1?min-1
.②该温度下,上述反应的平衡常数K=
0.0675
0.0675
.③反应在7~10min内,CO的物质的量减少的原因可能是
d
d
(填字母).a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在图C所示坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线.
下表为长式周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)图1中属于d区的元素是
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
 ;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为
;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的金属元素是
查看习题详情和答案>>

请回答下列问题:
(1)图1中属于d区的元素是
⑨
⑨
(填编号).(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为
MgCNi3或CMgNi3
MgCNi3或CMgNi3
(用对应的元素符号表示).(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
BD
BD
.A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
1
1
;该元素与元素①形成的18电子的X分子(分子量32)的电子式为

先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液
先产生蓝色沉淀,后沉淀消失,变成深蓝色的溶液
.(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
DEF
DEF
(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大
B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大
.