摘要:A 2.C 3.B 4.D 5.B 6.B 7.A 8.C 9.C 11.B 12.A 13.D 14.A
网址:http://m.1010jiajiao.com/timu3_id_37187[举报]
A、B、C、D、E五种元素分属三个短周期,且原子序数依次增大.A、C同主族.A与B、A与C、A与E、B与C可按原子个数比1:1分别形成化合物甲、乙、丙、丁,B、D同主族,可形成DB2、DB3两种分子.
回答下列问题:
(1)B在元素周期表中的位置为
(2)化合物乙的电子式为
 .
.
(3)B、E的单质及两元素之间形成的化合物中可作水消毒剂的有
(4)A2D的燃烧热△H=-a kJ/mol,写出A2D燃烧反应的热化学方程式:
(5)写出FeE2与物质丁按物质的量之比2:1的反应的离子方程式:
(6)熔融状态下,C的单质和FeE2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeE2
Fe+2ZE
放电时,电池的正极反应式为
以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,石墨为电极可构成一种性能优良的高效燃料电池.给上述电池充电,则与a电极相连的二甲醚电池电极上的反应式为
查看习题详情和答案>>

回答下列问题:
(1)B在元素周期表中的位置为
第二周期ⅥA族
第二周期ⅥA族
.(2)化合物乙的电子式为


(3)B、E的单质及两元素之间形成的化合物中可作水消毒剂的有
O3、Cl2、ClO2等
O3、Cl2、ClO2等
(写出其中两种物质的化学式)).(4)A2D的燃烧热△H=-a kJ/mol,写出A2D燃烧反应的热化学方程式:
2H2S+3O2=2SO2(g)+2H2O(l)△H=-2akJ/mol
2H2S+3O2=2SO2(g)+2H2O(l)△H=-2akJ/mol
.(5)写出FeE2与物质丁按物质的量之比2:1的反应的离子方程式:
6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+
6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+
.(6)熔融状态下,C的单质和FeE2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeE2
| 放电 | 充电 |
放电时,电池的正极反应式为
Fe2++2e-=Fe
Fe2++2e-=Fe
.以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,石墨为电极可构成一种性能优良的高效燃料电池.给上述电池充电,则与a电极相连的二甲醚电池电极上的反应式为
CH3OCH3+16OH--12e-=2CO32-+11H2O
CH3OCH3+16OH--12e-=2CO32-+11H2O
.A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式
 ;乙为由B元素组成的单质,写出该单质的一种用途
;乙为由B元素组成的单质,写出该单质的一种用途
(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:
 .
.
(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
查看习题详情和答案>>
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式


作保护气
作保护气
.(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
Fe3O4+8H+═2Fe3++Fe2++4H2O
Fe3O4+8H+═2Fe3++Fe2++4H2O
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
NH4NO2+AgNO3═AgNO2↓+NH4NO3
NH4NO2+AgNO3═AgNO2↓+NH4NO3
,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为C(NO2->C(NH4+)>C(H+)>C(OH-)
C(NO2->C(NH4+)>C(H+)>C(OH-)
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:


(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
.为探究该复盐中的某种离子,取少量该复盐于试管中并加水溶解,滴加铁氰化钾溶液(K3[Fe(CN)6]),则现象和结论为出现蓝色沉淀,证明有Fe2+
出现蓝色沉淀,证明有Fe2+
.A、B、C、D、E 5种元素,A元素所处的周期数、主族序数、原子序数均相等;B是地壳中含量最多的元素;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成离子化合物D2C.E的单质既能与强酸反应,又能与强碱反应放出氢气.
(1)B在周期表中的位置:第
(2)C的气态氢化物的电子式
 .
.
(3)D的最高价氧化物的水化物与E单质反应的离子方程式
(4)写出由这五种元素形成的某盐晶体化学式
(5)在①A2B、②D2B、③DBA、④B2、⑤DACB4、⑥D2C这6种物质中,只含共价键的是
查看习题详情和答案>>
(1)B在周期表中的位置:第
二
二
周期,第ⅥA
ⅥA
族.(2)C的气态氢化物的电子式


(3)D的最高价氧化物的水化物与E单质反应的离子方程式
2Al+2OH-+2e-=2AlO2-+3H2↑
2Al+2OH-+2e-=2AlO2-+3H2↑
.(4)写出由这五种元素形成的某盐晶体化学式
KAl(SO4)2?12H2O
KAl(SO4)2?12H2O
,它在日常生活中的作用是净水剂
净水剂
.(5)在①A2B、②D2B、③DBA、④B2、⑤DACB4、⑥D2C这6种物质中,只含共价键的是
①④
①④
;只含离子键的是②⑥
②⑥
;既含共价键又含离子键的是③⑤
③⑤
(均填数字序号).A(C10H10O2)是生产某新型工程塑料的基础原料之一,A没有酸性,能使溴水褪色.A在酸性条件下水解生成有机物B和甲醇.
现拟从芳香烃 出发来合成A,合成路线如下:
出发来合成A,合成路线如下:
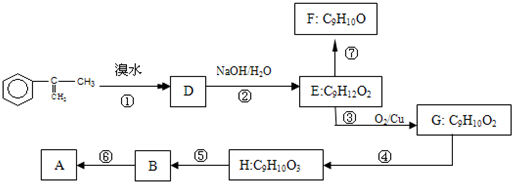
已知:烯醇结构不稳定,会自动异构化为醛:即R-CH=CH-OH→R-CH2-CHO.
(1)B中官能团的名称
(2)反应⑦属于消去反应
A加成反应 B消去反应 C氧化反应 D取代反应
(3)写出反应⑥的化学方程式: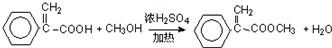

(4)反应⑦生成的有机物F有两种可能,结构简式分别为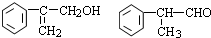
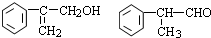 .
.
(5)①写出G与新制Cu(OH)2反应的方程式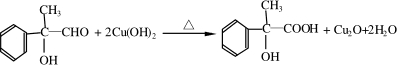

②与G互为同分异构体,能与NaHCO3溶液反应,且苯环上的一卤代物只有两种的G同分异构体有
(6)A在一定条件下能生成一种高分子化合物,写出该反应的化学方程式:
 .
.
查看习题详情和答案>>
现拟从芳香烃
 出发来合成A,合成路线如下:
出发来合成A,合成路线如下:
已知:烯醇结构不稳定,会自动异构化为醛:即R-CH=CH-OH→R-CH2-CHO.
(1)B中官能团的名称
羧基、碳碳双建
羧基、碳碳双建
(2)反应⑦属于消去反应
B
B
A加成反应 B消去反应 C氧化反应 D取代反应
(3)写出反应⑥的化学方程式:


(4)反应⑦生成的有机物F有两种可能,结构简式分别为
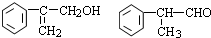
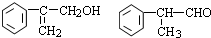
(5)①写出G与新制Cu(OH)2反应的方程式


②与G互为同分异构体,能与NaHCO3溶液反应,且苯环上的一卤代物只有两种的G同分异构体有
4
4
种.(6)A在一定条件下能生成一种高分子化合物,写出该反应的化学方程式:


A、B、C、D、E是五种常见的短周期主族元素,它们的原子序数依次增大,其中A与C、B与D分别同族,已知B、D两种元素原子核中质子数之和是A、C两种元素原子核中质子数的2倍,五种元素中只有一种为金属元素.请回答下列问题
(1)物质甲、乙是由上述五种元素中的两种元素形成的常温下为液体的化合物,则甲、乙的化学式
(2)已知:2DB2+B2 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
(3)丙、丁两化合物均由A、B、C、D四种元素组成,写出丙丁两化合物反应的化学反应方程式:
(4)将一定量的DB2通入到紫色石蕊试液中的现象是:
(5)用A、B两元素的单质可制成新型化学电源,若以C的最高价氧化物的水化物为电解质,则通A的一极的电极反应方程式:
查看习题详情和答案>>
(1)物质甲、乙是由上述五种元素中的两种元素形成的常温下为液体的化合物,则甲、乙的化学式
H2O或H2O2
H2O或H2O2
、H2O2或H2O
H2O2或H2O
,写出其中一种物质使酸性KMnO4溶液褪色的离子反应方程式5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑
5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑
.(2)已知:2DB2+B2
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热(30a+1.5b)
(30a+1.5b)
kJ(用a、b表示),我国工业生成DB2所用的原料是FeS2
FeS2
(填化学式)(3)丙、丁两化合物均由A、B、C、D四种元素组成,写出丙丁两化合物反应的化学反应方程式:
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
.(4)将一定量的DB2通入到紫色石蕊试液中的现象是:
溶液变为红色
溶液变为红色
.再通入等物质的量E2所观察的现象是溶液仍为红色
溶液仍为红色
.(5)用A、B两元素的单质可制成新型化学电源,若以C的最高价氧化物的水化物为电解质,则通A的一极的电极反应方程式:
H2+2OH--2e-→2H2O
H2+2OH--2e-→2H2O
.若以此电源进行铁片上镀铜,若两极质量差为6.4g时,理论上消耗标况下1.12
1.12
L的A单质.