摘要:11.9g锡与100mL12mol·L-1HNO3共热一段时间.完全反应后测定溶液中c(H+)为 8mol·L-1.溶液体积仍为100mL.放出的气体在标准状况下体积约为8.96L.由此推断氧化产物可是 ( ) A.SnO2·4H2O B.Sn(NO3)4 C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4 [解析]由氮元素守衡可知后来溶液中的氮与气体中的氮之和.恰好和原来100mL12mol·L-1HNO3中的氮相等.可见锡元素未与氮结合.[答案]A 二.本题包括两小题.共16分 17. 在常温常压下.注射器甲中装有N02气体.注射器乙中 装有相同体积的空气(如图所示.夹持仪器均已略去) (1)常温下.打开两个止水夹后.同时向外拉动两注射器的活塞.且拉动的距离相同.将会看到U形管中液面 a. .试解释这一现象: . (2)如将注射器甲中的气体换成NH3.U形管中的CCl4换成水.仍在常温下.打开两个止水夹后.同时向里推动两注射器的活塞.且推动的距离相同.将会看到U形管中液面a .试解释这一现象 [答案]向外拉活塞时.平衡2NO2N2O4向左移动.使甲中气体压强大于乙中气体压强 NH3几乎全部溶于水.使甲中气体压强小于乙中气体压强
网址:http://m.1010jiajiao.com/timu3_id_371597[举报]
11.9g锡与100mL12mol?L-1HNO3共热一段时间,完全反应后测定溶液中c(H+)为8mol?L-1,溶液体积仍为100mL。放出的气体在标准状况下体积约为8.96L。由此推断氧化产物可是( )
A.SnO2?4H2O B.Sn(NO3)4 C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
查看习题详情和答案>>|
11.9g锡与100mL12mol·L-1HNO3共热一段时间.完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL.放出的气体在标准状况下体积约为8.96L.由此推断氧化产物可是 | |
| [ ] | |
A. |
SnO2·4H2O |
B. |
Sn(NO3)4 |
C. |
Sn(NO3)2 |
D. |
Sn(NO3)2和Sn(NO3)4 |
图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分;
②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%.
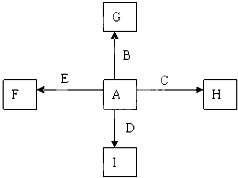
回答下列问题.
(1)反应①的化学方程式是 .
(2)化合物I中所存在的化学键是 键(填“离子”或“极性”或“非极性”).
(3)称取11.9g B、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用足量的稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液中加入过量的NaOH溶液,所得沉淀的质量为 .
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是: .
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 (从下面的选项中选择正确选项,下同),欲检验其中的Fe2+的方案是 .
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色.
查看习题详情和答案>>
①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分;
②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%.

回答下列问题.
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是
(3)称取11.9g B、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用足量的稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液中加入过量的NaOH溶液,所得沉淀的质量为
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色.
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.
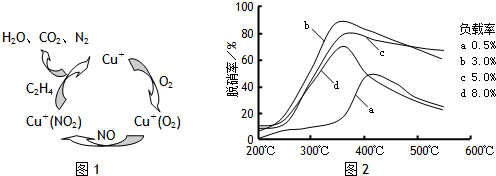
①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是
查看习题详情和答案>>
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3
| ||
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
-724.5kJ?mol-1
-724.5kJ?mol-1
.(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.

①写出该脱硝原理总反应的化学方程式:
6NO+3O2+2C2H4
3N2+4CO2+4H2O
| ||
6NO+3O2+2C2H4
3N2+4CO2+4H2O
.
| ||
②为达到最佳脱硝效果,应采取的条件是
350℃、负载率3%
350℃、负载率3%
.