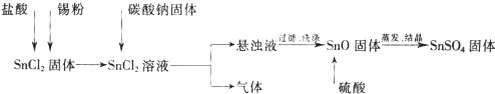
题目内容
11.9g锡与100mL12mol?L-1HNO3共热一段时间,完全反应后测定溶液中c(H+)为8mol?L-1,溶液体积仍为100mL。放出的气体在标准状况下体积约为8.96L。由此推断氧化产物可是( )
A.SnO2?4H2O B.Sn(NO3)4 C.Sn(NO3)2 D.Sn(NO3)2和Sn(NO3)4
A[解析]由氮元素守衡可知后来溶液中的氮与气体中的氮之和,恰好和原来100mL12mol?L-1HNO3中的氮相等,可见锡元素未与氮结合。[答案]A

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目