摘要:24.A.B.C.D是化学中常见的单质.其中A是用量最大.应用最广泛的金属.D是地壳中含量最多的金属元素.甲.乙.丙为化合物.其中甲为黑色晶体.乙在常温常压下为无色无味的液体.它们之间存在如图所示的转化关系.由此可推知: (1)元素A在周期表中的位置为 . (2)乙的电子式为 . (3)写出甲和D反应的化学方程式 .在此反应中生成1 mol A转移电子的物质的量为 mol. (4)已知D能与烧碱溶液反应.写出D与烧碱溶液反应的离子方程式: . (5)元素A的某种化合物常用于净水.请用离子方程式表示其净化原理 .
网址:http://m.1010jiajiao.com/timu3_id_368837[举报]
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A-I的所有物质之间有如下的转化关系: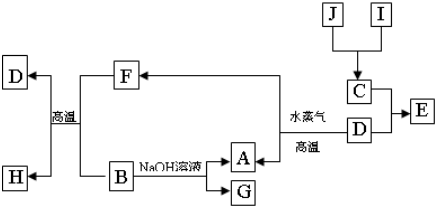
回答下列问题:
(1)写出物质C的构成元素在周期表中的位置
(2)写出B与F反应的化学方程式
(3)由E的饱和溶液可以制得胶体,具体制备方法是:
a.光束通过该液体时形成光亮的“通路”?
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生?
d.将该液体加热、蒸干、灼烧,得红棕色固体?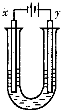
另取少量上述胶体置于U型管中,按如图装置图连接好装置.通电一小段时间后,X极附近的现象是
(4)取少量上述胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液颜色逐渐变浅,最终得到黄色的溶液,发生此变化的离子方程式为
(5)G的水溶液显
(6)J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
查看习题详情和答案>>

回答下列问题:
(1)写出物质C的构成元素在周期表中的位置
第三周期、第ⅦA族
第三周期、第ⅦA族
.(2)写出B与F反应的化学方程式
8Al+3Fe3O4
9Fe+4Al2O3
| ||
8Al+3Fe3O4
9Fe+4Al2O3
.
| ||
(3)由E的饱和溶液可以制得胶体,具体制备方法是:
将饱和FeCl3溶液逐滴加入沸水中,继续加热至液体变为红褐色
将饱和FeCl3溶液逐滴加入沸水中,继续加热至液体变为红褐色
,用化学方程式表示该过程的原理:Fe3++3H2O
Fe(OH)3(胶体)+3H+
| ||
Fe3++3H2O
Fe(OH)3(胶体)+3H+
.若要提纯该胶体,采用的操作方法叫
| ||
渗析
渗析
.此液体具有的性质是abd
abd
(填写序号字母)a.光束通过该液体时形成光亮的“通路”?
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生?
d.将该液体加热、蒸干、灼烧,得红棕色固体?

另取少量上述胶体置于U型管中,按如图装置图连接好装置.通电一小段时间后,X极附近的现象是
红褐色加深
红褐色加深
.(4)取少量上述胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液颜色逐渐变浅,最终得到黄色的溶液,发生此变化的离子方程式为
Fe(OH)3+3H+=Fe3++3H2O
Fe(OH)3+3H+=Fe3++3H2O
.(5)G的水溶液显
碱
碱
性(填酸或碱);原因是(用离子方程式表 示)AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
 Al(OH)3+OH-
Al(OH)3+OH-AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
. Al(OH)3+OH-
Al(OH)3+OH-(6)J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
MnO2+H2O2+2H+═Mn2++O2↑+2H2O
MnO2+H2O2+2H+═Mn2++O2↑+2H2O
.A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去).请填空:
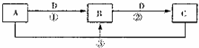
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
 Ⅰ
Ⅰ
①图中X、Y分别是
②写出燃料电池B中负极上发生的电极反应
查看习题详情和答案>>

(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是
FeCl3
FeCl3
;工业上制取A的离子方程式Ⅰ为2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式
2H2S+SO2=3S↓+H2O
2H2S+SO2=3S↓+H2O
.(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
 Ⅰ
Ⅰ①图中X、Y分别是
Cl2
Cl2
、H2
H2
(填化学式),分析比较图示中氢氧化钠质量分数a%>
>
b%(填“>”、“=”或“<”)②写出燃料电池B中负极上发生的电极反应
H2-2e-+2OH-=2H2O
H2-2e-+2OH-=2H2O
.A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).
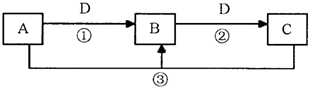
请填空:
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为
(3)若D的氯碱工业的主要产品,B有两性,则反应②的离子方程式是
(4)若D为酸或酸性气体,则A、C可以是
(5)若C是一种温室气体,D是空气的主要成分之一,1mol黑色固体A完全燃烧放出393.5kJ热量,1molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为
查看习题详情和答案>>

请填空:
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是
FeCl3
FeCl3
(只写一种).用有关离子方程式解释 B溶液显酸性的原因是:氯化铁水解而使其溶液呈酸性
氯化铁水解而使其溶液呈酸性
. (2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为
N2+O2
2NO
| ||
N2+O2
2NO
.
| ||
(3)若D的氯碱工业的主要产品,B有两性,则反应②的离子方程式是
Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
.(4)若D为酸或酸性气体,则A、C可以是
NaOH、NaHCO3或Fe、Fe(NO3)3
NaOH、NaHCO3或Fe、Fe(NO3)3
(请按顺序写出任意一组符合要求的物质的化学式)(5)若C是一种温室气体,D是空气的主要成分之一,1mol黑色固体A完全燃烧放出393.5kJ热量,1molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为
2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
.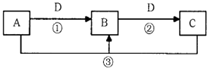 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:(1)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则用A制备漂白粉的化学方程式是
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.则C的化学式是FeCl2
FeCl2
.配制C的溶液时可加入少量的盐酸
盐酸
(填物质名称)以抑制水解.②若A是某强酸的稀溶液,则A的化学式可能是
HNO3
HNO3
.(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)若B有两性
①若D是强酸,则能确定A、C中肯定含的离子的化学式分别是
AlO2-
AlO2-
、Al3+
Al3+
.②若D是强碱,则反应②的离子方程式是
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(4)若A、B、C的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是
CO2
CO2
或SO2
SO2
(填化学式),鉴别它们常可选用品红溶液
品红溶液
、溴水或高锰酸钾溶液
溴水或高锰酸钾溶液
(任填两种试剂名称).A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如下图所示:
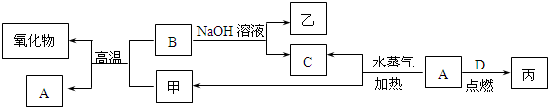
请回答下列问题:
(1)B与甲反应的化学方程式是
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
(4)写出A与水蒸气反应生成C和甲的化学方程式
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
mol(用含字母的分数式表示).
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
mol,混合物中A的质量为
×56
×56g(用含字母的分数式表示).
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为
查看习题详情和答案>>

请回答下列问题:
(1)B与甲反应的化学方程式是
3Fe3O4+8Al
9Fe+4Al2O3
| ||
3Fe3O4+8Al
9Fe+4Al2O3
.
| ||
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
否
否
(填“是”或“否”).(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+
取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+
.(4)写出A与水蒸气反应生成C和甲的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
,混合物中B的物质的量为| n |
| 33.6 |
| n |
| 33.6 |
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
| m |
| 11.2 |
| m |
| 11.2 |
| m-n |
| 22.4 |
| m-n |
| 22.4 |
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为
30%
30%
.