题目内容
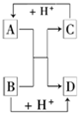
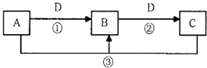 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:(1)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则用A制备漂白粉的化学方程式是
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.则C的化学式是FeCl2
FeCl2
.配制C的溶液时可加入少量的盐酸
盐酸
(填物质名称)以抑制水解.②若A是某强酸的稀溶液,则A的化学式可能是
HNO3
HNO3
.(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)若B有两性
①若D是强酸,则能确定A、C中肯定含的离子的化学式分别是
AlO2-
AlO2-
、Al3+
Al3+
.②若D是强碱,则反应②的离子方程式是
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(4)若A、B、C的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是
CO2
CO2
或SO2
SO2
(填化学式),鉴别它们常可选用品红溶液
品红溶液
、溴水或高锰酸钾溶液
溴水或高锰酸钾溶液
(任填两种试剂名称).分析:(1)若D是生产、生活中用量最大、用途最广的金属单质判断为Fe;
①若A可用于自来水消毒,证明为Cl2,则用A制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解;
②若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,判断为HNO3;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,判断A为碱性气体为NH3,B是汽车尾气之一,遇空气会变色,证明D为O2,反应①是氨气的催化氧化反应生成一氧化氮和水;
(3)若B有两性可能是两性氧化物或两性氢氧化物;
①若D是强酸,B为两性 氢氧化物为Al(OH)3,则能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+;
②若D是强碱,B为两性氢氧化物为Al(OH)3,A为Al3+反应②是氢氧化铝和强碱反应;
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2,依据性质鉴别可以用高锰酸钾溶液,品红试液.
①若A可用于自来水消毒,证明为Cl2,则用A制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解;
②若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,判断为HNO3;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,判断A为碱性气体为NH3,B是汽车尾气之一,遇空气会变色,证明D为O2,反应①是氨气的催化氧化反应生成一氧化氮和水;
(3)若B有两性可能是两性氧化物或两性氢氧化物;
①若D是强酸,B为两性 氢氧化物为Al(OH)3,则能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+;
②若D是强碱,B为两性氢氧化物为Al(OH)3,A为Al3+反应②是氢氧化铝和强碱反应;
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2,依据性质鉴别可以用高锰酸钾溶液,品红试液.
解答:解:(1)若D是生产、生活中用量最大、用途最广的金属单质判断为Fe;
①若A可用于自来水消毒,证明为Cl2,则用A制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
;C为FeCl2;配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;FeCl2 ;盐酸;
②若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,判断为HNO3,故答案为:HNO3;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,判断A为碱性气体为NH3,B是汽车尾气之一,遇空气会变色,证明D为O2,反应①是氨气的催化氧化反应生成一氧化氮和水;化学方程式为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(3)若B有两性可能是两性氧化物或两性氢氧化物;
①若D是强酸,B为两性 氢氧化物为Al(OH)3,则能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+,故答案为:AlO2-;Al3+;
②若D是强碱,B为两性氢氧化物为Al(OH)3,A为Al3+反应②是氢氧化铝和强碱反应,反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2,依据性质鉴别可以用高锰酸钾溶液,品红试液,
故答案为:品红溶液;溴水或高锰酸钾溶液;
①若A可用于自来水消毒,证明为Cl2,则用A制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
;C为FeCl2;配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;FeCl2 ;盐酸;
②若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,判断为HNO3,故答案为:HNO3;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,判断A为碱性气体为NH3,B是汽车尾气之一,遇空气会变色,证明D为O2,反应①是氨气的催化氧化反应生成一氧化氮和水;化学方程式为:4NH3+5O2
| ||
| △ |
| ||
| △ |
(3)若B有两性可能是两性氧化物或两性氢氧化物;
①若D是强酸,B为两性 氢氧化物为Al(OH)3,则能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+,故答案为:AlO2-;Al3+;
②若D是强碱,B为两性氢氧化物为Al(OH)3,A为Al3+反应②是氢氧化铝和强碱反应,反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2,依据性质鉴别可以用高锰酸钾溶液,品红试液,
故答案为:品红溶液;溴水或高锰酸钾溶液;
点评:本题考查了物质转化关系的推断和应用,物质性质的应用,主要考查氯强碱化合物、铝及其化合物、氮及其化合物性质、铁及其化合物性质的综合应用,难度中等.

练习册系列答案
相关题目
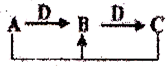 A、B、C、D是中学化学常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )
A、B、C、D是中学化学常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )| A、若D为H2O,A为碳,则A和C反应生成1 mol B转移的电子数为NA | ||
| B、若D为Fe,A为CI2,则B溶液蒸干后可得到纯净的B固体 | ||
| C、若D为O2,A为碱性气体,则以上转化只涉及两个氧化还原反应 | ||
D、若D为HCl,A为Na2CO3,则B溶液中c(Na+)=c(HCO3-)+2c(CO
|
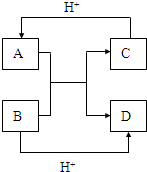 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.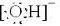
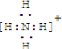
 已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系: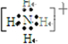
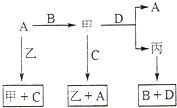 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空: A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:
A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空: