摘要:4] B
网址:http://m.1010jiajiao.com/timu3_id_36791[举报]
4-硫醚基喹唑啉类化合物是一种具有应用前景的抑菌药物,其合成路线如下:

已知:
(1)写出反应类型A→B
(2)满足下列条件的C的同分异构体的结构简式有
①苯的衍生物,且苯环上的一取代产物有两种;②苯环上有四个取代基,其中三个为甲氧基(-OCH3),其在苯环上位置与C相同;③含-COO-基团.
(3)写出C→D的化学方程式
 .由C→D的反应中还可能生成一种有机副产物,该副产物的结构简式为
.由C→D的反应中还可能生成一种有机副产物,该副产物的结构简式为
 .
.
(4)写出物质G的结构简式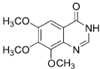
 .
.
(5)利用题给相关信息,以甲苯、HCONH2为原料,合成 .合成过程中无机试剂任选;合成路线流程图示例为:
.合成过程中无机试剂任选;合成路线流程图示例为:
提示:① ; ②
; ② ;③
;③

 .
.
查看习题详情和答案>>

已知:

(1)写出反应类型A→B
取代反应
取代反应
,E→F还原反应
还原反应
.(2)满足下列条件的C的同分异构体的结构简式有
4
4
种(不包含C).①苯的衍生物,且苯环上的一取代产物有两种;②苯环上有四个取代基,其中三个为甲氧基(-OCH3),其在苯环上位置与C相同;③含-COO-基团.
(3)写出C→D的化学方程式




(4)写出物质G的结构简式


(5)利用题给相关信息,以甲苯、HCONH2为原料,合成
 .合成过程中无机试剂任选;合成路线流程图示例为:
.合成过程中无机试剂任选;合成路线流程图示例为:
提示:①
 ; ②
; ② ;③
;③


4种短周期元素A、B、C、D的相关信息如下:信息①原子半径大小:A>B>C>D信息②4种元素的原子之间形成的甲、乙和丙3种物质的部分信息如下:
请根据上述信息回答下列问题.
(1)元素B在周期表中的位置
 .
.
(2)元素E、F与元素A处于同一周期,E单质的还原性最强,且与甲能反应生成化合物X.含元素F的某些盐可作为净水剂,由元素F、C组成的化合物Y可作为耐火材料.
①写出元素A的单质与甲反应的化学方程式:
②写出化合物Y溶解于X溶液的离子方程式:
查看习题详情和答案>>
| 甲 | 乙 | 丙 | |
| 分子 比例模型 |
 |
 |
 |
| 物质性质 | 地球上最常见的物质,是组成生物体的重要物质之一,约占人体质量的2/3. | 无色,无气味并且易燃.是常见的一种基础能源. | 有强氧化性的弱酸,可以用于消毒杀菌. |
(1)元素B在周期表中的位置
第2周期IVA族
第2周期IVA族
,丙分子的电子式

(2)元素E、F与元素A处于同一周期,E单质的还原性最强,且与甲能反应生成化合物X.含元素F的某些盐可作为净水剂,由元素F、C组成的化合物Y可作为耐火材料.
①写出元素A的单质与甲反应的化学方程式:
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
.②写出化合物Y溶解于X溶液的离子方程式:
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.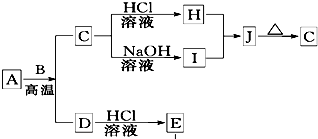 B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.(1)在E的溶液中加入氢氧化钠溶液,可以观察到的现象是
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
.(2)按要求写化学方程式或离子方程式:
①A与B在高温条件下生成C和D的化学方程式:
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
;
| ||
②在E的水溶液中通入氯气后的生成物和I溶液反应的离子方程式:
Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓
Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓
.(3)由D和A组成的混合物与稀HCl作用,固体恰好溶解,所得溶液中滴加KSCN溶液不显红色,且生成的E与H2的物质的量之比为4:1.则反应物中A、D、HCl的物质的量之比为
1:2:8
1:2:8
.
