网址:http://m.1010jiajiao.com/timu3_id_36782[举报]
| 元素符号 | 元素性质或结构信息 |
| A | 原子核外L层未成对电子数最多 |
| B | 原子半径是短周期主族元素中最大的 |
| C | 地壳中含量最多的金属元素 |
| D | 原子核外有五种不同能量的电子,且最外层有2对成对电子 |
(2)元素A的原子核外有
(3)D的最高价氧化物中D原子的杂化类型是
(4)B的氯化物的晶体类型是
(5)A的每个双原子分子中含有

(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有
请回答以下问题:
(1)请画出F的离子结构示意图:
(2)工业上制取E单质的化学方程式为:
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料.通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式:
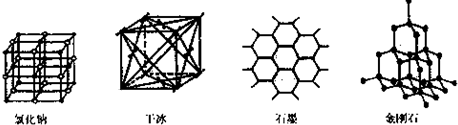
(5)如图是中学常见的几种晶体结构.有关说法正确的是
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的.
现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。

A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
查看习题详情和答案>>(22分) I.下图中A、B、C、D、E、F、G均为有机化合物。

根据上图回答问题:
(1)D的化学名称是_____________;B的结构简式是______________________;
(2)反应④的化学方程式是___________________________________________;
(3)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途。________________________________________________________________。
II. 一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
回答下列问题:
(1)目前工业上生产乙烯主要是以石油为原料通过________反应来实现。
(2)化合物Ⅲ生成化合物Ⅳ的副产物为________________________;
(3)写出合成路线中从化合物Ⅳ到化合物Ⅴ的反应方程式:
___________________________________________________________________;
(4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是 ____________(填字母)。
A.化合物Ⅲ可以发生氧化反应 B.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
C.化合物Ⅳ能与氢气发生加成反应 D.化合物Ⅴ可以发生水解反应
E化合物Ⅲ、Ⅳ和Ⅴ均可与金属钠反应生成氢气 F.化合物Ⅲ不可以与NaOH 溶液反应
查看习题详情和答案>>