摘要:A.B.C.D四种短周期元素的原子半径依次减小.A与C的核电荷数之比为3∶4.D能分别与A.B.C形成电子总数相等的分子X.Y.Z.下列叙述正确的是 A.X.Y.Z的稳定性逐渐减弱 B.A.B.C.D只能形成5种单质 C.Z. Y.X三种化合物的熔沸点逐渐升高 D.自然界中存在多种由A.B.C.D四种元素组成的化合物
网址:http://m.1010jiajiao.com/timu3_id_36629[举报]
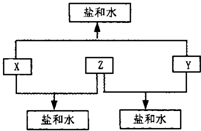 (2010?潍坊一模)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.
(2010?潍坊一模)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.(1)D元素原子的结构示意图为
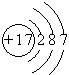
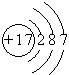
(2)A、B、C三种元素的原子半径由小到大的顺序为
N<Al<Na
N<Al<Na
(用元素符号表示);(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
Al2O3+2OH-+3H2O=2[Al(OH)4]-
Al2O3+2OH-+3H2O=2[Al(OH)4]-
;(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈
酸
酸
(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(Cl-)
c(OH-)<c(H+)<c(NH4+)<c(Cl-)
(用具体离子符号表示);(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是
4HNO3(浓)
4NO2↑+O2↑+2H2O
| ||
4HNO3(浓)
4NO2↑+O2↑+2H2O
(用化学方程式表示).
| ||
有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅占据一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p轨道电子数比s轨道电子数少1,C为金属元素且原子核外p轨道电子数和s轨道电子数相等;D元素的原子核外所有p轨道全满或半满.
(1)写出四种元素的元素符号:A
(2)写出D元素基态原子的外围电子排布式:
(3)写出B、C两种元素的单质在一定条件下反应的化学方程式
(4)写出C元素形成的氯化物的电子式:
 .
.
查看习题详情和答案>>
(1)写出四种元素的元素符号:A
H
H
;BN
N
;CMg
Mg
;DP
P
.(2)写出D元素基态原子的外围电子排布式:
3s23p3
3s23p3
;(3)写出B、C两种元素的单质在一定条件下反应的化学方程式
3Mg+N2
Mg3N2
| ||
3Mg+N2
Mg3N2
.
| ||
(4)写出C元素形成的氯化物的电子式:


A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |
有常见A、B、C、D四种短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数比B多三个,C元素原子最外层电子数是D元素原子最外层电子数的一半.甲、乙、丙是3种含氧酸的B盐,其焰色反应均呈黄色;甲中含C元素,乙中含D元素,丙中含A元素,甲、丙溶液PH>7,乙溶液PH<7;丁为气体,戊为淡黄色固体.甲、乙、丙、丁、戊、己、庚七种物质之间的相互反应关系如图:
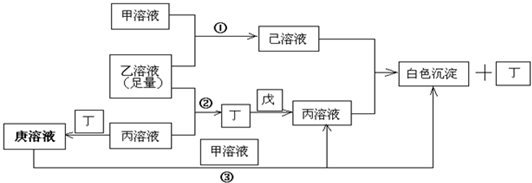
(1)画出D元素原子结构示意简图
 ,戊的电子式
,戊的电子式
 ;
;
(2)丙溶液呈碱性的原因
(3)写出有关反应①②③的离子方程式:
①
②
③
由反应③可得结论:甲和庚溶液的碱性甲
查看习题详情和答案>>

(1)画出D元素原子结构示意简图




(2)丙溶液呈碱性的原因
CO32-水解使溶液呈碱性
CO32-水解使溶液呈碱性
;(3)写出有关反应①②③的离子方程式:
①
AlO2-+4H+=Al3++2H2O
AlO2-+4H+=Al3++2H2O
;②
2H++CO32-=H2O+CO2↑
2H++CO32-=H2O+CO2↑
;③
HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓
HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓
;由反应③可得结论:甲和庚溶液的碱性甲
>
>
庚(填>、<或=).A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍.请填写下列空格:
(1)请写出A的元素符号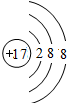
 ;
;
(3)A的单质能在D的最高价氧化物中燃烧,反应的方程式为
(4)B的最价氧化物可溶于氢氧化钠溶液写出反应的离子方程式
(5)C、D最高价氧化物对应的水化物酸性
可设计简单实验证明,实验步骤如下:
查看习题详情和答案>>
(1)请写出A的元素符号
Mg
Mg
;(2)C离子的结构示意图

(3)A的单质能在D的最高价氧化物中燃烧,反应的方程式为
2Mg+CO2
C+2MgO
| ||
2Mg+CO2
C+2MgO
.
| ||
(4)B的最价氧化物可溶于氢氧化钠溶液写出反应的离子方程式
Al2O3+2OH-═2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-)
Al2O3+2OH-═2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-)
.(5)C、D最高价氧化物对应的水化物酸性
HClO4
HClO4
强于H2CO3
H2CO3
(填化学式)可设计简单实验证明,实验步骤如下:
将HClO4溶液滴入Na2CO3溶液中,有无色无味使澄清石灰水便混浊的气体生成
将HClO4溶液滴入Na2CO3溶液中,有无色无味使澄清石灰水便混浊的气体生成
.