题目内容
A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍.请填写下列空格:
(1)请写出A的元素符号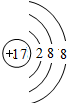
 ;
;
(3)A的单质能在D的最高价氧化物中燃烧,反应的方程式为
(4)B的最价氧化物可溶于氢氧化钠溶液写出反应的离子方程式
(5)C、D最高价氧化物对应的水化物酸性
可设计简单实验证明,实验步骤如下:
(1)请写出A的元素符号
Mg
Mg
;(2)C离子的结构示意图

(3)A的单质能在D的最高价氧化物中燃烧,反应的方程式为
2Mg+CO2
C+2MgO
| ||
2Mg+CO2
C+2MgO
.
| ||
(4)B的最价氧化物可溶于氢氧化钠溶液写出反应的离子方程式
Al2O3+2OH-═2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-)
Al2O3+2OH-═2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-)
.(5)C、D最高价氧化物对应的水化物酸性
HClO4
HClO4
强于H2CO3
H2CO3
(填化学式)可设计简单实验证明,实验步骤如下:
将HClO4溶液滴入Na2CO3溶液中,有无色无味使澄清石灰水便混浊的气体生成
将HClO4溶液滴入Na2CO3溶液中,有无色无味使澄清石灰水便混浊的气体生成
.分析:A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的
,令最外层电子数为x,则×
×(10+x)=x,解得x=2,故A为镁元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为铝元素;C-离子核外电子层数比A元素的离子核外电子层数多1,镁离子有2个电子层,则C-离子有3个电子层,核外电子数为18,故C为氯元素;D元素原子最外层电子数是次外层的2倍,则D有2个电子层,最外层电子数为4,则D为碳元素.
(1)A为镁元素.
(2)氯离子核外有3个电子层,最外层有8个电子.
(3)镁在二氧化碳中燃烧生成碳和氧化镁.
(4)氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,氢氧化钠与偏铝酸钠应写出离子.
(5)元素的非金属性越强,最高价氧化物对应的水化物酸性越强;利用强酸制弱酸原理设计实验验证酸性强弱.
| 1 |
| 6 |
| 1 |
| 6 |
(1)A为镁元素.
(2)氯离子核外有3个电子层,最外层有8个电子.
(3)镁在二氧化碳中燃烧生成碳和氧化镁.
(4)氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,氢氧化钠与偏铝酸钠应写出离子.
(5)元素的非金属性越强,最高价氧化物对应的水化物酸性越强;利用强酸制弱酸原理设计实验验证酸性强弱.
解答:解:A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的
,令最外层电子数为x,则×
×(10+x)=x,解得x=2,故A为镁元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为铝元素;C-离子核外电子层数比A元素的离子核外电子层数多1,镁离子有2个电子层,则C-离子有3个电子层,核外电子数为18,故C为氯元素;D元素原子最外层电子数是次外层的2倍,则D有2个电子层,最外层电子数为4,则D为碳元素.
(1)由上述分析可知A为Mg元素.
故答案为:Mg.
(2)氯离子质子数为17,核外电子数为18,核外有3个电子层,最外层有8个电子,氯离子结构示意图为 .
.
故答案为: .
.
(3)镁在二氧化碳中燃烧生成碳和氧化镁,反应方程式为2Mg+CO2
C+2MgO.
故答案为:2Mg+CO2
C+2MgO.
(4)氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应离子方程式为Al2O3+2OH-═2AlO2-+H2O.或者写成
Al2O3+2OH-+3H2O=2[Al(OH)4]-.
故答案为:Al2O3+2OH-═2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-).
(5)非金属性Cl>C,所以最高价氧化物对应的水化物酸性HClO4>H2CO3.将HClO4溶液滴入Na2CO3溶液中,有无色无味使澄清石灰水便混浊的气体生成.
故答案为:HClO4;H2CO3;将HClO4溶液滴入Na2CO3溶液中,有无色无味使澄清石灰水便混浊的气体生成.
| 1 |
| 6 |
| 1 |
| 6 |
(1)由上述分析可知A为Mg元素.
故答案为:Mg.
(2)氯离子质子数为17,核外电子数为18,核外有3个电子层,最外层有8个电子,氯离子结构示意图为
 .
.故答案为:
 .
.(3)镁在二氧化碳中燃烧生成碳和氧化镁,反应方程式为2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
(4)氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应离子方程式为Al2O3+2OH-═2AlO2-+H2O.或者写成
Al2O3+2OH-+3H2O=2[Al(OH)4]-.
故答案为:Al2O3+2OH-═2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-).
(5)非金属性Cl>C,所以最高价氧化物对应的水化物酸性HClO4>H2CO3.将HClO4溶液滴入Na2CO3溶液中,有无色无味使澄清石灰水便混浊的气体生成.
故答案为:HClO4;H2CO3;将HClO4溶液滴入Na2CO3溶液中,有无色无味使澄清石灰水便混浊的气体生成.
点评:以元素推断为载体,考查结构与位置关系、离子方程式和原子结构示意图等常用化学用语、元素周期律及实验设计,难度不大,是对所学知识的综合运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |
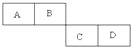 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.