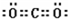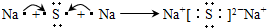题目内容
有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅占据一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p轨道电子数比s轨道电子数少1,C为金属元素且原子核外p轨道电子数和s轨道电子数相等;D元素的原子核外所有p轨道全满或半满.
(1)写出四种元素的元素符号:A
(2)写出D元素基态原子的外围电子排布式:
(3)写出B、C两种元素的单质在一定条件下反应的化学方程式
(4)写出C元素形成的氯化物的电子式:
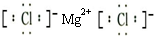 .
.
(1)写出四种元素的元素符号:A
H
H
;BN
N
;CMg
Mg
;DP
P
.(2)写出D元素基态原子的外围电子排布式:
3s23p3
3s23p3
;(3)写出B、C两种元素的单质在一定条件下反应的化学方程式
3Mg+N2
Mg3N2
| ||
3Mg+N2
Mg3N2
.
| ||
(4)写出C元素形成的氯化物的电子式:
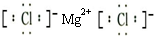
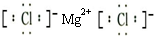
分析:有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅占据一种原子轨道,也是宇宙中最丰富的元素,则A为氢元素;B元素原子的核外p轨道电子数比s轨道电子数少1,B原子核外电子排布为1s22s22p3,为N元素;C为金属元素且原子核外p轨道电子数和s轨道电子数相等,原子序数等于氮元素,处于第三周期,核外电子排布为1s22s22p63s2,则C为Mg元素,D元素的原子核外所有p轨道全满或半满,原子序数大于Mg,则核外电子排布为1s22s22p63s23p3,则D为P元素,据此解答.
解答:解:有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅占据一种原子轨道,也是宇宙中最丰富的元素,则A为氢元素;B元素原子的核外p轨道电子数比s轨道电子数少1,B原子核外电子排布为1s22s22p3,为N元素;C为金属元素且原子核外p轨道电子数和s轨道电子数相等,原子序数等于氮元素,处于第三周期,核外电子排布为1s22s22p63s2,则C为Mg元素,D元素的原子核外所有p轨道全满或半满,原子序数大于Mg,则核外电子排布为1s22s22p63s23p3,则D为P元素,
(1)由上述分析可知,A为H;B为N;C为Mg;D为P,
故答案为:H;N;Mg;P;
(2)D为P元素,原子核外电子排布为1s22s22p63s23p3,其基态原子的外围电子排布式:3s23p3,
故答案为:3s23p3;
(3)镁在氮气中燃烧生成二氮化三镁,反应方程式为:3Mg+N2
Mg3N2,
故答案为:3Mg+N2
Mg3N2;
(4)氯化镁属于离子化合物,由镁离子与氯离子构成,氯化镁电子式为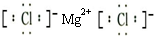 ,
,
故答案为: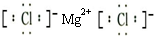 .
.
(1)由上述分析可知,A为H;B为N;C为Mg;D为P,
故答案为:H;N;Mg;P;
(2)D为P元素,原子核外电子排布为1s22s22p63s23p3,其基态原子的外围电子排布式:3s23p3,
故答案为:3s23p3;
(3)镁在氮气中燃烧生成二氮化三镁,反应方程式为:3Mg+N2
| ||
故答案为:3Mg+N2
| ||
(4)氯化镁属于离子化合物,由镁离子与氯离子构成,氯化镁电子式为
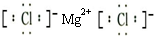 ,
,故答案为:
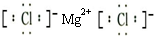 .
.点评:本题考查结构性质位置关系、核外电子排布规律、处于化学用语,难度不大,掌握核外电子排布规律是推断的关键.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目