网址:http://m.1010jiajiao.com/timu3_id_362083[举报]
(15分)下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式_________________________。
(3)反应②离子方程式__________________________。
(4)F→M的操作方法_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________。
A.原子半径 X<Y<C B.离子半径 X<C<Y
C.非金属性 X<Y<C D.最高价氧化物对应水化物酸性 C>X>Y
E.氢化物沸点 X<Y<C
② 请写出X的氢化物中原子个数比为1:1的化合物的电子式_________。
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)。
A.AlO2— B.OH— C.SiO32—
查看习题详情和答案>>
(15分)下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。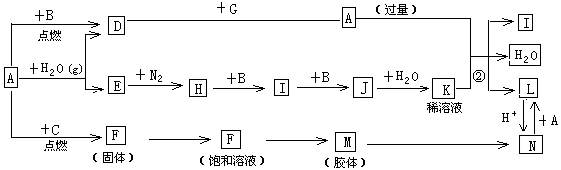
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式_________________________。
(3)反应②离子方程式__________________________。
(4)F→M的操作方法_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________。
A.原子半径 X<Y<C B.离子半径 X<C<Y
C.非金属性 X<Y<C D.最高价氧化物对应水化物酸性 C>X>Y
E.氢化物沸点 X<Y<C
②请写出X的氢化物中原子个数比为1:1的化合物的电子式_________。
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)。
A.AlO2— B.OH— C.SiO32—
下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
 |
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________
(2)D与G反应的化学方程式_________________________
(3)反应②离子方程式__________________________
(4)F→M的操作方法_______________
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________
A 原子半径 X〈 Y〈 C B 离子半径 X〈 C〈 Y
C 非金属性 X〈 Y〈 C D 最高价氧化物对应水化物酸性 C 〉X 〉Y
E 氢化物沸点 X〈 Y〈 C
② 请写出X的氢化物中原子个数比为1:1的化合物的电子式_________
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
 |
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)
A. AlO2— B. OH— C. SiO32—
查看习题详情和答案>>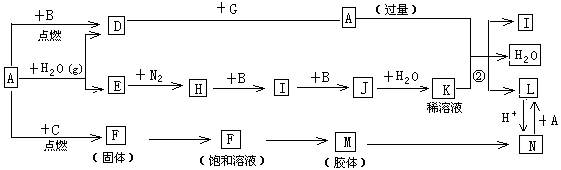
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式_________________________。
(3)反应②离子方程式__________________________。
(4)F→M的操作方法_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________。
A.原子半径 X<Y<C B.离子半径 X<C<Y
C.非金属性 X<Y<C D.最高价氧化物对应水化物酸性 C>X>Y
E.氢化物沸点 X<Y<C
②请写出X的氢化物中原子个数比为1:1的化合物的电子式_________。
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
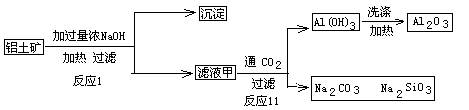
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)。
A.AlO2— B.OH— C.SiO32—
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
(2)已知:下表是14种元素的电负性的数值(用X表示).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为


③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)