摘要:混合相同物质的量浓度的200mLBa(OH)2溶液和150mLNaHCO3溶液.最终所得溶液中各离子物质的量浓度大小顺序为 A [OH-]>[Ba2+]>[Na+]=[HCO32-] B [OH-]>[Ba2+]>[Na+]>[HCO32-] C [OH-]>[Ba2+]>[Na+]>[CO32-] D [OH-]>[Na+] >[Ba2+]>[CO32-]
网址:http://m.1010jiajiao.com/timu3_id_361949[举报]
室温时,下列混合溶液的pH一定小于7的是( )
| A、相同物质的量浓度的醋酸溶液和氢氧化钠溶液等体积混合 | B、相同物质的量浓度的盐酸和氨水等体积混合 | C、pH=3的硫酸溶液和pH=11的氨水等体积混合 | D、pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
下列说法正确的是( )
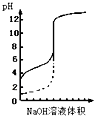

| A、△H>0的反应,常温下一定不能自发进行 | B、用0.1mol/L NaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 | C、等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | D、恒容密闭容器中进行的反应3A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将减小 |
合成氨工业对化学工业和国防工业具有重要意义.
(1)常温下氨气极易溶于水,其水溶液可以导电.
①用方程式表示氨气溶于水的过程中存在的可逆过程
②氨水中水电离出的c(OH-)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到依次为
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B.A为铵盐,B在标准状况下为气态.在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA.
①写出氨气和氟气反应的化学方程式
②在标准状况下,每生成1mol B,转移电子的物质的量为
(3)Ⅰ在某压强恒定的密闭容器中加入2mol N2和4mol H2,发生如下反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol达到平衡时,体积为反应前的三分之二.求:
①达到平衡时,N2的转化率为
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.试比较反应放出的能量:①
Ⅱ若将2mol N2和4mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡.
③试比较平衡时NH3的浓度:Ⅰ
查看习题详情和答案>>
(1)常温下氨气极易溶于水,其水溶液可以导电.
①用方程式表示氨气溶于水的过程中存在的可逆过程
NH3+H2O?NH3?H2O?NH4++OH-
NH3+H2O?NH3?H2O?NH4++OH-
②氨水中水电离出的c(OH-)
<
<
10-7mol/L(填写“>”、“<”或“=”)③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到依次为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
.(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B.A为铵盐,B在标准状况下为气态.在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA.
①写出氨气和氟气反应的化学方程式
4NH3+3F2
NF3+3NH4F(催化剂要注明是铜)
| ||
4NH3+3F2
NF3+3NH4F(催化剂要注明是铜)
;
| ||
②在标准状况下,每生成1mol B,转移电子的物质的量为
6
6
mol.(3)Ⅰ在某压强恒定的密闭容器中加入2mol N2和4mol H2,发生如下反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol达到平衡时,体积为反应前的三分之二.求:
①达到平衡时,N2的转化率为
50%
50%
.②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.试比较反应放出的能量:①
>
>
②(填“>”、“<”或“=”)Ⅱ若将2mol N2和4mol H2放入起始体积相同的恒容容器中,在与Ⅰ相同的温度下达到平衡.
③试比较平衡时NH3的浓度:Ⅰ
>
>
Ⅱ(填“>”、“<”或“=”).