摘要:10.(1)C.E,2NaCl+H2SO4(浓) Na2SO4+2HCl↑ (2)5.1.2.6.7.4.3 (3)浓H2SO4.NaOH溶液.NaCl固体.MgCl2·6H2O,浓H2SO4 (4)吸收HCl气体.防止污染空气
网址:http://m.1010jiajiao.com/timu3_id_360219[举报]
现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A、D同主族C、E 同主族,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子M、N,且N为比较常见的液态化合物.请回答下列问题:
(1)B的简单阴离子的结构示意图
 .
.
(2)A、D、E三种元素组成的化合物电子式为:

(3)①C、D、E对应的简单离子的半径由大到小为
(4)A、C、E三种元素能形成多种18电子分子,写出其中两种所能发生的反应方程式
(5)标况下,1gD单质在C单质中完全燃烧可放出QKJ热量.则此反应的热化学方程式为
查看习题详情和答案>>
(1)B的简单阴离子的结构示意图


(2)A、D、E三种元素组成的化合物电子式为:


(3)①C、D、E对应的简单离子的半径由大到小为
S2->O2->Na+
S2->O2->Na+
(用离子符号表示)②写出能证明C和E非金属性强弱的一个化学方程式2H2S+O2═2H2O+2S
2H2S+O2═2H2O+2S
.(4)A、C、E三种元素能形成多种18电子分子,写出其中两种所能发生的反应方程式
H2O2+H2S=S↓+2H2O
H2O2+H2S=S↓+2H2O
(5)标况下,1gD单质在C单质中完全燃烧可放出QKJ热量.则此反应的热化学方程式为
2Na(s)+O2(g)=Na2O2(s)△H=-46QkJ/mol
2Na(s)+O2(g)=Na2O2(s)△H=-46QkJ/mol
.现有A、B、C、D、E、F六种物质,它们的相互转化关系如下图所示.已知A和B是单质,B、E、F在常温下为气体,C为淡黄色固体.

(1)写出A、B的化学式:A
(2)写出A生成C的化学方程式
(3)写出C与D反应生成E的化学方程式
查看习题详情和答案>>

(1)写出A、B的化学式:A
Na
Na
,BH2
H2
(2)写出A生成C的化学方程式
2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
| ||
(3)写出C与D反应生成E的化学方程式
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.(2013?和平区二模)有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D元素在周期表中的位置为
(2)可以比较D和F得电子能力强弱的是
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有
 .
.
(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.
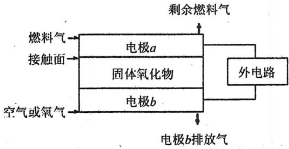
①固体氧化物中的O2-向
②电极b为电池
③若A2作为燃料气,则接触面上发生的反应为
④若B2A4作为燃料气,则接触面上发生的反应为
查看习题详情和答案>>
(1)D元素在周期表中的位置为
第二周期第VIA族
第二周期第VIA族
.(2)可以比较D和F得电子能力强弱的是
bc
bc
(填写编号).a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有
离子键、共价键
离子键、共价键
;并写出其中阳离子的电子式

(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol
.(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.

①固体氧化物中的O2-向
负
负
(填“正”或“负”)极移动.②电极b为电池
正
正
极,其电极反应式为O2+4e-=2O2-
O2+4e-=2O2-
.③若A2作为燃料气,则接触面上发生的反应为
H2+O2--2e-=H2O
H2+O2--2e-=H2O
.④若B2A4作为燃料气,则接触面上发生的反应为
C2H4+6O2--12e-=2CO2+2H2O
C2H4+6O2--12e-=2CO2+2H2O
.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.
请回答下列问题:
(1)E、F气态氢化物的稳定性为
(2)E与F可形成E2F2的化合物,其电子式为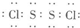
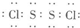 ,其晶体类型为
,其晶体类型为
(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为:
(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与a g铜反应,则被还原的H的物质的量为
mol
mol.
(5)E的一种常见氧化物为大气污染物,实验室可用足量D的最高价氧化物的水化物来吸收,则吸收生成的盐溶液中离子浓度大小关系为:
(6)b g D单质在纯净的C单质中燃烧放出Q kJ热量,则相关的热化学方程式为:
查看习题详情和答案>>
请回答下列问题:
(1)E、F气态氢化物的稳定性为
HCl
HCl
>H2S
H2S
(用化学式表示).(2)E与F可形成E2F2的化合物,其电子式为
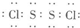
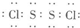
分子晶体
分子晶体
.(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为:
Na2O2+S2-+2H2O=S↓+2Na++4OH-
Na2O2+S2-+2H2O=S↓+2Na++4OH-
.(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与a g铜反应,则被还原的H的物质的量为
| a |
| 64 |
| a |
| 64 |
(5)E的一种常见氧化物为大气污染物,实验室可用足量D的最高价氧化物的水化物来吸收,则吸收生成的盐溶液中离子浓度大小关系为:
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
.(6)b g D单质在纯净的C单质中燃烧放出Q kJ热量,则相关的热化学方程式为:
2Na(s)+O2(g)=Na2O2(s)△H=-
kJ/mol
| 46Q |
| b |
2Na(s)+O2(g)=Na2O2(s)△H=-
kJ/mol
.| 46Q |
| b |
X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F.已知:化合物A、B、C中原子个数比都为1:1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等.请回答下列问题:
(1)X元素的名称是
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)
(3)写出F的电子式

(4)已知X单质、A、B、D均为固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应.请写出X单质、B分别与E反应的化学方程式
B中含有的化学键是
(5)请写出由化合物C制取Y的单质反应的化学方程式
查看习题详情和答案>>
(1)X元素的名称是
钠
钠
,它在周期表中的位置第三周期第IA族
第三周期第IA族
.(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)
Na>O>H
Na>O>H
(3)写出F的电子式


(4)已知X单质、A、B、D均为固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应.请写出X单质、B分别与E反应的化学方程式
2Na+2H2O=4NaOH+H2↑
2Na+2H2O=4NaOH+H2↑
,2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;B中含有的化学键是
离子键和非极性键
离子键和非极性键
;(5)请写出由化合物C制取Y的单质反应的化学方程式
2H2O2 2H2O+O2↑
2H2O+O2↑
 2H2O+O2↑
2H2O+O2↑2H2O2 2H2O+O2↑
2H2O+O2↑
. 2H2O+O2↑
2H2O+O2↑