摘要:22].“黑盒子 表面有a.b.c三个接线柱.盒内总共有两个电学元件.每两个接线柱之间只可能连接一个元件.为了探明盒内元件的种类及连接方式.某位同学用多用电表进行了如下探测: 第一步:用电压挡.对任意两接线柱正.反向测量.指针幸免不发生偏转, 第二步:用电阻×100Ω挡.对任意两个接线柱正.反向测量.指针偏转情况如下图所示. (1)第一步测量结果表明盒内 . (2)下左图示出了上图[1]和[2]中欧姆表指针所处的位置.其对应的阻值是 Ω, 下右图示出了上图[3]中欧姆表指钟所处的位置.其对应的阻值是 Ω. (3)请在下左图的接线柱间.用电路图符号画出盒内的元件及连接情况. (4)一个小灯泡与3V电池组的连接情况如上右图所示.如果把图中e.f两端用导线直接相连.小灯泡可正常发光.欲将e.f两端分别与黑盒子上的两个接线柱相连.使小灯泡仍可发光.那么.e端应连接到 接线柱.f端应连接到 接线柱. [23].AB是竖直平面内的四分之一圆弧轨道.在下端B与水平直轨道相切.如图所示.一小球自A点起由静止开始沿轨道下滑.已知圆轨道半径为R.小球的质量为m.不计各处摩擦.求 (1)小球运动到B点时的动能, (2)小球下滑到距水平轨道的高度为1/2R时速度的大小和方向, (3)小球经过圆弧轨道的B点和水平轨道的C点时.所受轨道支持力NB.NC各是多大?
网址:http://m.1010jiajiao.com/timu3_id_35863[举报]
 I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是ABC
ABC
A.温度越高,镁与水反应的速率越快
B.镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑
C.氢氧化镁显碱性,且在水中有一定的溶解性
D.氢氧化镁是离子化合物,它的电子式可表示为:

II 一定温度下,在容积为 VL的密闭容器中进行反应:aN(g)
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示:(1)此反应的化学方程式中a/b=
2
2
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
| 1 |
| (t2-t1)×v |
| 1 |
| (t2-t1)×v |
(3)下列叙述能说明上述反应达到平衡状态的是
C、E
C、E
(填序号)A.反应中M与N的物质的量之比为1:1
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.正反应速率与逆反应速率均为零.
某研究性学习小组对Mg和Al的性质进行了下列的实验及研究.
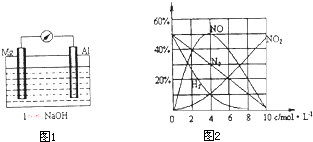
(1)以镁条、铝片为电极,稀NaOH溶液为电解质构成的原电池(如图1所示)时发现,刚开始时,电流表指针向右偏转,镁条做负极;但随后很快指针又向左偏转,镁条表面有极少量的气泡产生.
①开始阶段,负极发生的反应是 .
②随后阶段,铝片发生的电极反应式是 ;则镁电极发生的电极反应式是 .
(2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如图2所示,溶液中的产物有Mg(NO3)2、NH4NO3和H2O.96mgMg在1L4mol?L-1的HNO3中完全溶解,并可收集到22.4mL(标准状况下)气体(忽略反应过程中HNO3浓度的变化),该反应的化学方程式是 .
查看习题详情和答案>>

(1)以镁条、铝片为电极,稀NaOH溶液为电解质构成的原电池(如图1所示)时发现,刚开始时,电流表指针向右偏转,镁条做负极;但随后很快指针又向左偏转,镁条表面有极少量的气泡产生.
①开始阶段,负极发生的反应是
②随后阶段,铝片发生的电极反应式是
(2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如图2所示,溶液中的产物有Mg(NO3)2、NH4NO3和H2O.96mgMg在1L4mol?L-1的HNO3中完全溶解,并可收集到22.4mL(标准状况下)气体(忽略反应过程中HNO3浓度的变化),该反应的化学方程式是
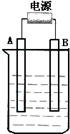 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成.请回答下列问题:(1)请写出B极板的名称及反应式:
(2)写出电解时反应的总离子方程式
(3)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.电解后溶液的pH为
(4)若原溶液为1L K2SO4、CuSO4的混合溶液,且c(SO42-)=2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解.则原溶液中的c(K+)为多少?(请简单表示计算过程)
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.(1)写出试管B中的实验现象
品红溶液褪色
品红溶液褪色
.(2)写出A中反应的化学方程式
Cu+2H2SO4
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4
CuSO4+SO2↑+2H2O
| ||
(3)继续向A试管中加入H2O2,发现铜片溶解,反应的离子方程式为:
Cu+H2O2+2H+=Cu2++2H2O
Cu+H2O2+2H+=Cu2++2H2O
.若仍不补充浓硫酸,只要求使铜片溶解,也可以加入(填写两种属于不同类别物质的化学式)
Fe2O3
Fe2O3
、NaNO3
NaNO3
.(4)B试管口的棉花应沾有的试剂是
NaOH(溶液)
NaOH(溶液)
.(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
①在他们的实验操作中,至少称量
4
4
次;②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
偏小
偏小
(填“偏大”、“偏小”),这次实验中产生误差的原因可能是AD
AD
(填序号)A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却.
 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成.请回答下列问题:(1)请写出B极板的名称:
阳极
阳极
电极反应式4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
写出电解时反应的总离子方程式
2Cu2++2H2O
2Cu+O2↑+4H+
| ||
2Cu2++2H2O
2Cu+O2↑+4H+
| ||
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.电解后溶液的pH为
PH=1
PH=1
;要使电解后溶液恢复到电解前的状态,则需加入CuO
CuO
,其质量为2
2
g.(假设电解前后溶液的体积不变)(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c(SO42-)=2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解.则原溶液中的c(K+)=
2mol/L
2mol/L
.