题目内容
某研究性学习小组对Mg和Al的性质进行了下列的实验及研究.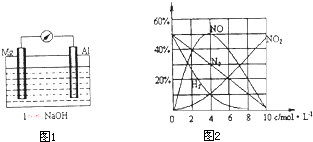
(1)以镁条、铝片为电极,稀NaOH溶液为电解质构成的原电池(如图1所示)时发现,刚开始时,电流表指针向右偏转,镁条做负极;但随后很快指针又向左偏转,镁条表面有极少量的气泡产生.
①开始阶段,负极发生的反应是
②随后阶段,铝片发生的电极反应式是
(2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如图2所示,溶液中的产物有Mg(NO3)2、NH4NO3和H2O.96mgMg在1L4mol?L-1的HNO3中完全溶解,并可收集到22.4mL(标准状况下)气体(忽略反应过程中HNO3浓度的变化),该反应的化学方程式是
分析:(1)①一般较活泼金属做负极,所以镁做负极失电子;
②生成的氢氧化镁难溶物附着在电极表面,阻止反应的进一步进行,铝成为新的负极;镁做正极;
(2)96mg Mg与1L 4mol/L的HNO3充分反应,Mg的物质的量比较少,反应中硝酸过量,由图象可知:n(NO):n(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,根据Mg失去电子总数与气体得到电子数之差,求出NH4+的量,再通过原子守恒配平方程.
②生成的氢氧化镁难溶物附着在电极表面,阻止反应的进一步进行,铝成为新的负极;镁做正极;
(2)96mg Mg与1L 4mol/L的HNO3充分反应,Mg的物质的量比较少,反应中硝酸过量,由图象可知:n(NO):n(N2):n(NO2):n(H2)=5:3:1:1,同时还原产物还有NH4+,根据Mg失去电子总数与气体得到电子数之差,求出NH4+的量,再通过原子守恒配平方程.
解答:解:(1)①镁较活泼所以做负极,Mg失电子变成Mg2+,负极反应为Mg+2OH--2e-=Mg(OH)2↓,故答案为:Mg+2OH--2e-=Mg(OH)2↓;
②Mg虽比Al活泼,但Mg不能与NaOH溶液反应,而Al可与NaOH溶液反应,故Al作负极,失电子生成Al3+,Al3+结合OH-生成AlO2,镁做正极,H+在镁电极上得电子生成氢气,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
(2)Mg与总气体物质的量比值为4:1,
由图知:NO2:H2:N2:NO=1:1:3:5,
写方程的时设NO2、H2、N2、NO系数分别为1,1,3,5,Mg为40
根据电子转移的数目:产生1molNO2,转移1mol.同理H2:2mol,N2:10mol,NO:3mol
因此总共转移电子为1×1+1×2+3×10+5×3=48mol
但是40mol的Mg,转移80mol电子,还差了32mol
所以一定是还有NH4NO3生成,生成1molNH4NO3,转移8mol电子,现在有32mol电子所以是4molNH4NO3,
再根据N守恒,H守恒,反应为40Mg+100HNO3=5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O,
故答案为:40Mg+100HNO3=5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O.
②Mg虽比Al活泼,但Mg不能与NaOH溶液反应,而Al可与NaOH溶液反应,故Al作负极,失电子生成Al3+,Al3+结合OH-生成AlO2,镁做正极,H+在镁电极上得电子生成氢气,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
(2)Mg与总气体物质的量比值为4:1,
由图知:NO2:H2:N2:NO=1:1:3:5,
写方程的时设NO2、H2、N2、NO系数分别为1,1,3,5,Mg为40
根据电子转移的数目:产生1molNO2,转移1mol.同理H2:2mol,N2:10mol,NO:3mol
因此总共转移电子为1×1+1×2+3×10+5×3=48mol
但是40mol的Mg,转移80mol电子,还差了32mol
所以一定是还有NH4NO3生成,生成1molNH4NO3,转移8mol电子,现在有32mol电子所以是4molNH4NO3,
再根据N守恒,H守恒,反应为40Mg+100HNO3=5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O,
故答案为:40Mg+100HNO3=5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O.
点评:本题(1)考查了原电池正负极电极反应式的书写,根据电极上得失电子来判断正负极,然后书写电极反应式,(2)为易错点氧化还原方程式的配平,题目难度很大,要求学生对氧化还原反应掌握比较深入,同时有比较好的数学功底.

练习册系列答案
相关题目
(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
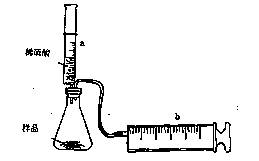 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
|
|
50mL稀硫酸 |
50mL稀硫酸 |
50mL稀硫酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
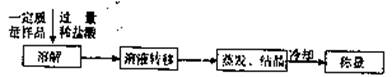
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。