网址:http://m.1010jiajiao.com/timu3_id_35753[举报]
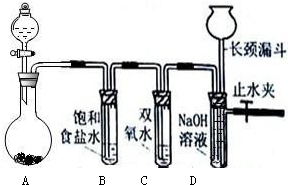
(1)试管B中饱和食盐水的作用
(2)试管C中加入5mL 30%双氧水,发生反应的化学方程式
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为
(5)有的同学对上述实验中试管D中气体来源产生质疑,你认为可能的来源有
I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是 Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生称FeCl3,当铁粉过量时产物是FeCl2,为了验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是
⑵设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在溶液中加KSCN溶液 |
| 固体物质中有FeCl3 |
在KMnO4溶液中加少量A 溶液 | KmnO4溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:
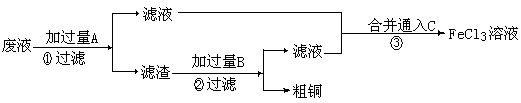
⑶①写出一个能证明还原性Fe比Cu强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:
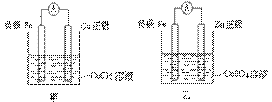
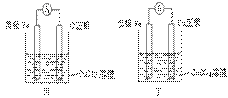
四位同学的设计的原电池装置图,符合上述反应原理的是 。
③请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
查看习题详情和答案>>过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。

(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。

(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3•3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
查看习题详情和答案>>
某校研究小组为探究KI溶液的pH与其在空气之中氧化变质的关系,进行了相应的实验探究。
【提出假设】
假设1:只有碱性环境下能被氧化
假设2:只有酸性环境下能被氧化
假设3:只有中性环境下能被氧化
假设4: 能被氧化
【实验探究】
(1)有人认为由于I2会和KOH反应,因此否定假设1。小组同学认为,若溶液的碱性较弱时,I2不会反应。为了验证滚点,小组同学进行了下述实验:
在编号为①②③的试管中加入相同量的碘的淀粉溶液中,然后分别加入pH为9、10、11的KOH溶液,发现试管①中蓝色不消失,试管②③中蓝色消失。
由此可以得出结论: 。
(2)为探究KI溶液在不同碱性条件下能否被氧气氧化,小组同学设计了以下实验:将下表中的药品分别加入到试管中,然后放置于收集有氧气的储气瓶中,塞上塞子,观察现象。完成以下实验设计表(表中不要留空格)。
|
实验编号 |
蒸馏水 |
淀粉溶液 |
KI固体 |
稀KOH溶液 |
一段时间后观察实验现象 |
|
1 |
30mL |
2 mL |
5g |
0滴 |
试管中出现了蓝色 |
|
2 |
29.5 mL |
|
5g |
10滴 |
试管中出现了很浅的淡蓝色 |
|
3 |
29 mL |
2 mL |
|
20滴 |
试管中无明显变化 |
|
4 |
|
2 mL |
5g |
30滴 |
|
注:1滴溶液体积为0.05mL。
(3)小组同学通过实验证实了在酸性条件下KI都能被氧气氧化,现继续探究酸性强弱与氧化难易的关系。有同学提出假设,认为酸性越强越容易被氧化。请设计实验验证假设,完成下表中内容。
可供选择的药品有:KI固体、淀粉溶液、0.005mol/L H2SO4、0.5mol/L H2SO4 。
|
实验方案(不要求写具体过程) |
预期实验结果和结论 |
|
|
|
查看习题详情和答案>>
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用如图K16-2所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。

图K16-2
(1)若在烧瓶中放入1.30 g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是________________________________________。
A.200 mL B.400 mL C.500 mL
(2)若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重1.28 g,则圆底烧瓶中发生反应的化学方程式为______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到V mL气体,则有:a g÷65 g·mol-1=b g÷64 g·mol-1+V mL/22400 mL·mol-1,依据的原理是___________________________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,n(H2)/n(SO2)=______________________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U形管,n(H2)/n(SO2)的数值将________(填“偏大”“偏小”或“无影响”)。
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①________________________________________________________;
②________________________________________________________;
③____________________________________________________________。
查看习题详情和答案>>