题目内容
某校研究小组为探究KI溶液的pH与其在空气之中氧化变质的关系,进行了相应的实验探究。
【提出假设】
假设1:只有碱性环境下能被氧化
假设2:只有酸性环境下能被氧化
假设3:只有中性环境下能被氧化
假设4: 能被氧化
【实验探究】
(1)有人认为由于I2会和KOH反应,因此否定假设1。小组同学认为,若溶液的碱性较弱时,I2不会反应。为了验证滚点,小组同学进行了下述实验:
在编号为①②③的试管中加入相同量的碘的淀粉溶液中,然后分别加入pH为9、10、11的KOH溶液,发现试管①中蓝色不消失,试管②③中蓝色消失。
由此可以得出结论: 。
(2)为探究KI溶液在不同碱性条件下能否被氧气氧化,小组同学设计了以下实验:将下表中的药品分别加入到试管中,然后放置于收集有氧气的储气瓶中,塞上塞子,观察现象。完成以下实验设计表(表中不要留空格)。
|
实验编号 |
蒸馏水 |
淀粉溶液 |
KI固体 |
稀KOH溶液 |
一段时间后观察实验现象 |
|
1 |
30mL |
2 mL |
5g |
0滴 |
试管中出现了蓝色 |
|
2 |
29.5 mL |
|
5g |
10滴 |
试管中出现了很浅的淡蓝色 |
|
3 |
29 mL |
2 mL |
|
20滴 |
试管中无明显变化 |
|
4 |
|
2 mL |
5g |
30滴 |
|
注:1滴溶液体积为0.05mL。
(3)小组同学通过实验证实了在酸性条件下KI都能被氧气氧化,现继续探究酸性强弱与氧化难易的关系。有同学提出假设,认为酸性越强越容易被氧化。请设计实验验证假设,完成下表中内容。
可供选择的药品有:KI固体、淀粉溶液、0.005mol/L H2SO4、0.5mol/L H2SO4 。
|
实验方案(不要求写具体过程) |
预期实验结果和结论 |
|
|
|
假设4:在一定pH范围内(1分,合理表述均给分)
(1)碘单质只有在pH大于一定值时才能和碱性溶液反应(1分,合理表述均给分)
(2)
|
实验编号 |
蒸馏水 |
淀粉溶液 |
KI固体 |
稀KOH溶液 |
一段时间后观察实验现象 |
|
1 |
|
|
|
|
|
|
2 |
|
2mL |
|
|
|
|
3 |
|
|
5g |
|
[] |
|
4 |
28.5 mL |
|
|
|
试管中无明显变化 |
(3)
|
实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
|
在编号为①②③的试管中分别加入0.005mol/L H2SO4、0.05mol/L H2SO4、0.5mol/L H2SO4各30mL,然后再向三只试管中分别加入2mL淀粉溶液、5g KI固体(2分) |
若都出现蓝色,且①②③试管中颜色依次加深,则酸性越强越容易被氧化,假设正确。否则,假设错误。 (1分) |
【解析】
试题分析:结合题目前后的实验探究过程,可得出假设4为在一定pH范围内能被氧化。
(1)实验现象说明碱性较弱时,碘单质不会和碱发生反应
(2)根据变量控制的思想,不难填充表格中的数据,第4组中KOH滴加得最多,碱性最强,可推知试管中也无明显变化。
考点:考查化学实验探究,实验设计知识。

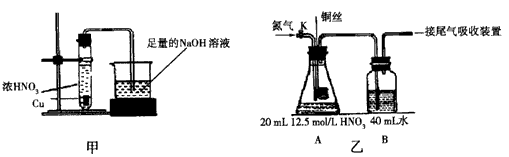
(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、
18.4 mol·L-1)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积的2 mol·L-1的硫酸于试管中 |
反应速率Al>Fe,Cu不反应[来源:学,科,网Z,X,X,K] |
金属的性质越活泼,反应速率越快 |
|
②__________ |
(1)甲同学表中实验步骤②为
(2)甲同学的实验目的是
要得出正确的实验结论,还需控制的实验条件是
(3)乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。乙同学在实验中应该测定的数据是
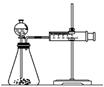
(4)乙同学完成该实验应选用的实验药品是
该实验中不选用某浓度的硫酸,理由是
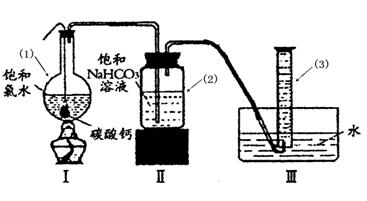
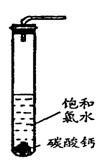 ②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;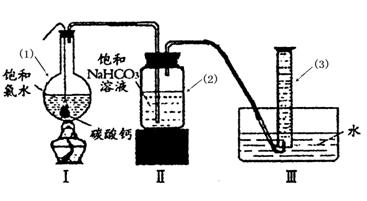
 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7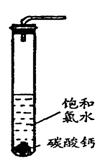 ②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;