网址:http://m.1010jiajiao.com/timu3_id_35688[举报]
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、
 、Cl一四种离子,且c(
、Cl一四种离子,且c(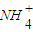 )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 .
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 .(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: .
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 .
(4)以石墨电极电解100mL 0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为 g.
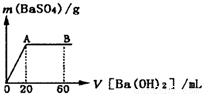
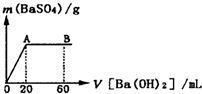
(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)= mol?L-1.
(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+
I2(g)?2HI(g)△H=-14.9kJ?mol-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度 | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
A.α1+α2=1 B.2α2=α3 C.a+b=14.9 D.c1=c2=c3.
 查看习题详情和答案>>
查看习题详情和答案>>
 (2011?郑州二模)利用所学化学反应原理,解决以下问题:
(2011?郑州二模)利用所学化学反应原理,解决以下问题:(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、N
| H | + 4 |
| H | + 4 |
(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是
(4)以石墨电极电解100mL 0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为
(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=
(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+
I2(g)?2HI(g)△H=-14.9kJ?mol-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度(mol?L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
A.α1+α2=1 B.2α2=α3 C.a+b=14.9 D.c1=c2=c3.
(一)(1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图: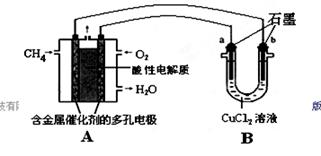
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH  C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO32- H++HPO32-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4 Ba2++SO42- Ba2++SO42- | | 1.07×10-10 |
| BaCO3 | BaCO3 Ba2++CO32- Ba2++CO32- | | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4- 均可看作酸,则它们酸性由强到弱的顺序为__________________________(填编号);
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(3)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( );
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)=" c" (C6H5O-)+ c (C6H5OH)
(4)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
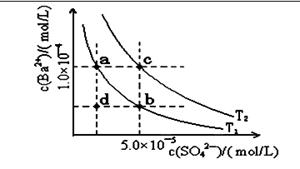
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时, 均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、 b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点 查看习题详情和答案>>
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:

请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH  C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO32- H++HPO32-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4 Ba2++SO42- Ba2++SO42- | | 1.07×10-10 |
| BaCO3 | BaCO3 Ba2++CO32- Ba2++CO32- | | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4- 均可看作酸,则它们酸性由强到弱的顺序为__________________________(填编号);
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(3)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( );
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)=" c" (C6H5O-)+ c (C6H5OH)
(4)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )

A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时, 均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、 b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
(一) (1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
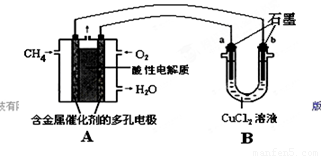
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
|
电解质 |
平衡方程式 |
平衡常数K |
Ksp |
|
CH3COOH |
CH3COOH |
1.76×10-5 |
|
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
|
|
C6H5OH |
C6H5OH |
1.1×10-10 |
|
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
|
|
BaSO4 |
BaSO4 |
|
1.07×10-10 |
|
BaCO3 |
BaCO3 |
|
2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4- 均可看作酸,则它们酸性由强到弱的顺序为__________________________(填编号);
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(3)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( );
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
(4)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
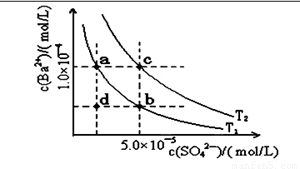
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时, 均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、 b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
查看习题详情和答案>>
 CH3COO-+H+
CH3COO-+H+ C6H5O-+H+
C6H5O-+H+ NH4++OH-
NH4++OH-