题目内容
利用所学化学反应原理,解决以下问题:(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、
 、Cl一四种离子,且c(
、Cl一四种离子,且c(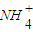 )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 .
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 .(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: .
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 .
(4)以石墨电极电解100mL 0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为 g.
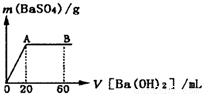
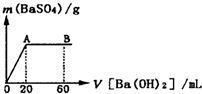
(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)= mol?L-1.
(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+
I2(g)?2HI(g)△H=-14.9kJ?mol-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度 | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
A.α1+α2=1 B.2α2=α3 C.a+b=14.9 D.c1=c2=c3.
【答案】分析:(1)如溶液为NH4Cl,则溶液中存在c(Cl-)>c(NH4+)>c(H+)>c(OH-),如溶液为NH3?H2O,则溶液中存在
c(NH4+)c(OH-)>c(H+),而c(NH4+)>c(Cl-)>c(OH-)>c(H+),则应为NH4Cl和 NH3?H2O的混合物;
(2)二者完全反应生成硫酸铵,铵根离子水解,溶液呈酸性;
(3)根据溶度积比较三种盐的溶解性,越易溶解的物质,R+浓度越大,根据溶度积计算;
(4)电解CuSO4溶液,阴极反应为:Cu2++2e-=Cu,阳极反应为:2H2O-4e-=4H++O2↑,根据两极得失电子相等计算;
(5)根据反应SO42-+Ba2+=BaSO4↓,以及H++OH-=H2O计算;
(6)根据可逆反应的特点从等效平衡的角度分析.
解答:解:(1)如溶液为NH4Cl,则溶液中存在c(Cl-)>c(NH4+)>c(H+)>c(OH-),如溶液为NH3?H2O,则溶液中存在
c(NH4+)c(OH-)>c(H+),而c(NH4+)>c(Cl-)>c(OH-)>c(H+),则应为NH4Cl和 NH3?H2O的混合物,
故答案为:NH4Cl和 NH3?H2O;
(2)二者完全反应生成硫酸铵,铵根离子水解,溶液呈酸性,反应的实质为NH4++H2O NH3?H2O+H+,
NH3?H2O+H+,
故答案为:NH4++H2O NH3?H2O+H+;
NH3?H2O+H+;
(3)由Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12可知,
RX溶液中c(R+)=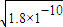 ,RY溶液中c(R+)=
,RY溶液中c(R+)=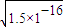 ,R2Z溶液中c(R+)=
,R2Z溶液中c(R+)=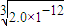 ,
,
则R+浓度由大到小的顺序是R2Z>RX>RY,
故答案为:R2Z>RX>RY;
(4)电解CuSO4溶液,阴极反应为:Cu2++2e-=Cu,阳极反应为:2H2O-4e-=4H++O2↑,
当Cu完全析出时,生成n(O2)= ×0.01mol=0.005mol,而此时在阳极生成0.01mol气体,则标明Cu完全析出,在阴极上还发生:2H++2e-=H2↑,所以生成的铜为m(Cu)=0.01mol×64g/mol=0.64g,
×0.01mol=0.005mol,而此时在阳极生成0.01mol气体,则标明Cu完全析出,在阴极上还发生:2H++2e-=H2↑,所以生成的铜为m(Cu)=0.01mol×64g/mol=0.64g,
故答案为:0.64;
(5)c(Ba(OH)2)= ×c(OH-)=0.05mol/L,整个过程发生反应分别为:SO42-+Ba2+=BaSO4↓,以及H++OH-=H2O,
×c(OH-)=0.05mol/L,整个过程发生反应分别为:SO42-+Ba2+=BaSO4↓,以及H++OH-=H2O,
由图象可知:n(H2SO4)=n(Ba(OH)2)=0.05mol/L×0.02L=0.001mol,
加入Ba(OH)2溶液60mL时酸碱恰好完全中和,
则有:2×n(H2SO4)+0.02L×c(HCl)=0.06L×0.1mol/L,
c(HCl)=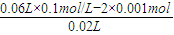 =0.2mol/L,
=0.2mol/L,
故答案为:0.2;
(6)根据反应H2(g)+I2(g) 2HI(g)△H=-14.9kJ?mol-1,由表中数据判断:
2HI(g)△H=-14.9kJ?mol-1,由表中数据判断:
甲、乙、丙为等效平衡,分别从正逆反应两个方向进行,达到相同平衡状态,则有:α1+α2=1;a+b=14.9;2c1=2c2=c3;
α2=α3 ; 所以只有AC正确.
故答案为:AC;
点评:本题考查较为综合,涉及弱电解质的电离、盐类的水解、难溶电解质的溶解平衡、电化学以及化学平衡知识,题目难度较大,本题易错点为(6),注意从等效平衡的角度分析.
c(NH4+)c(OH-)>c(H+),而c(NH4+)>c(Cl-)>c(OH-)>c(H+),则应为NH4Cl和 NH3?H2O的混合物;
(2)二者完全反应生成硫酸铵,铵根离子水解,溶液呈酸性;
(3)根据溶度积比较三种盐的溶解性,越易溶解的物质,R+浓度越大,根据溶度积计算;
(4)电解CuSO4溶液,阴极反应为:Cu2++2e-=Cu,阳极反应为:2H2O-4e-=4H++O2↑,根据两极得失电子相等计算;
(5)根据反应SO42-+Ba2+=BaSO4↓,以及H++OH-=H2O计算;
(6)根据可逆反应的特点从等效平衡的角度分析.
解答:解:(1)如溶液为NH4Cl,则溶液中存在c(Cl-)>c(NH4+)>c(H+)>c(OH-),如溶液为NH3?H2O,则溶液中存在
c(NH4+)c(OH-)>c(H+),而c(NH4+)>c(Cl-)>c(OH-)>c(H+),则应为NH4Cl和 NH3?H2O的混合物,
故答案为:NH4Cl和 NH3?H2O;
(2)二者完全反应生成硫酸铵,铵根离子水解,溶液呈酸性,反应的实质为NH4++H2O
 NH3?H2O+H+,
NH3?H2O+H+,故答案为:NH4++H2O
 NH3?H2O+H+;
NH3?H2O+H+;(3)由Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12可知,
RX溶液中c(R+)=
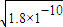 ,RY溶液中c(R+)=
,RY溶液中c(R+)=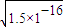 ,R2Z溶液中c(R+)=
,R2Z溶液中c(R+)=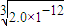 ,
,则R+浓度由大到小的顺序是R2Z>RX>RY,
故答案为:R2Z>RX>RY;
(4)电解CuSO4溶液,阴极反应为:Cu2++2e-=Cu,阳极反应为:2H2O-4e-=4H++O2↑,
当Cu完全析出时,生成n(O2)=
 ×0.01mol=0.005mol,而此时在阳极生成0.01mol气体,则标明Cu完全析出,在阴极上还发生:2H++2e-=H2↑,所以生成的铜为m(Cu)=0.01mol×64g/mol=0.64g,
×0.01mol=0.005mol,而此时在阳极生成0.01mol气体,则标明Cu完全析出,在阴极上还发生:2H++2e-=H2↑,所以生成的铜为m(Cu)=0.01mol×64g/mol=0.64g,故答案为:0.64;
(5)c(Ba(OH)2)=
 ×c(OH-)=0.05mol/L,整个过程发生反应分别为:SO42-+Ba2+=BaSO4↓,以及H++OH-=H2O,
×c(OH-)=0.05mol/L,整个过程发生反应分别为:SO42-+Ba2+=BaSO4↓,以及H++OH-=H2O,由图象可知:n(H2SO4)=n(Ba(OH)2)=0.05mol/L×0.02L=0.001mol,
加入Ba(OH)2溶液60mL时酸碱恰好完全中和,
则有:2×n(H2SO4)+0.02L×c(HCl)=0.06L×0.1mol/L,
c(HCl)=
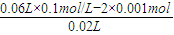 =0.2mol/L,
=0.2mol/L,故答案为:0.2;
(6)根据反应H2(g)+I2(g)
 2HI(g)△H=-14.9kJ?mol-1,由表中数据判断:
2HI(g)△H=-14.9kJ?mol-1,由表中数据判断:甲、乙、丙为等效平衡,分别从正逆反应两个方向进行,达到相同平衡状态,则有:α1+α2=1;a+b=14.9;2c1=2c2=c3;
α2=α3 ; 所以只有AC正确.
故答案为:AC;
点评:本题考查较为综合,涉及弱电解质的电离、盐类的水解、难溶电解质的溶解平衡、电化学以及化学平衡知识,题目难度较大,本题易错点为(6),注意从等效平衡的角度分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2011?郑州二模)利用所学化学反应原理,解决以下问题:
(2011?郑州二模)利用所学化学反应原理,解决以下问题: NH3?H2O+H+
NH3?H2O+H+

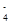 、Cl-四种离子,且c(NH
、Cl-四种离子,且c(NH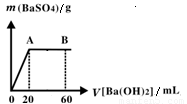

 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达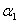 +
+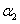 =1
B.2
=1
B.2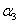 C.a+b=14.9
D.c1=c2=c3
C.a+b=14.9
D.c1=c2=c3