网址:http://m.1010jiajiao.com/timu3_id_356826[举报]
已知甲、乙、丙均为常见气体,其中甲在空气中含量最多,乙在相同条件下密度最小,丙有刺激性气味,且一个丙分子由四个原子构成.
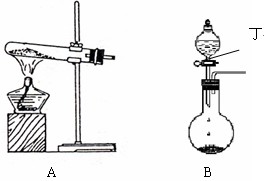
(1)实验室中可用下图A或B装置与相应的药品制得丙.
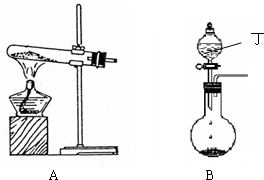
①A中试管内反应的化学方程式是______.
②B中分液漏斗内盛放的物质丁是______,圆底烧瓶内的物质是______.(均填名称)
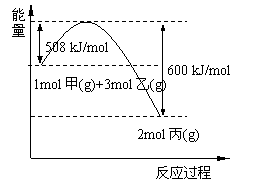
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
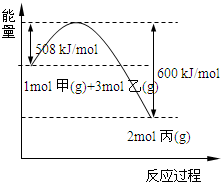
该反应的热化学方程式是______.
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是______.
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是______.
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | ______ | ______ |
| ______ | 固体全部溶解,有气泡产生 | ______ | ______ |
(1)实验室中可用下图A或B装置与相应的药品制得丙.
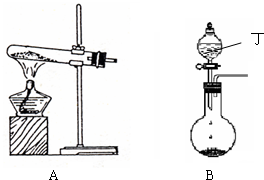
①A中试管内反应的化学方程式是______.
②B中分液漏斗内盛放的物质丁是______,圆底烧瓶内的物质是______.(均填名称)
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
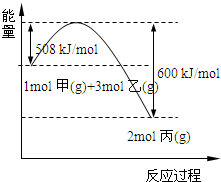
该反应的热化学方程式是______.
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是______.
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是______.
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | ______ | ______ |
| ______ | 固体全部溶解,有气泡产生 | ______ | ______ |
已知甲、乙、丙均为常见气体,其中甲在空气中含量最多,乙在相同条件下密度最小,丙有刺激性气味,且一个丙分子由四个原子构成。
(1)实验室中可用下图A或B装置与相应的药品制得丙。
① A中试管内反应的化学方程式是 。
② B中分液漏斗内盛放的物质丁是 ,圆底烧瓶内的物质是 。(均填名称)
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙。下图是甲和乙反应过程中能量变化图:
 |
该反应的热化学方程式是 。
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是 。
(4)① 将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是 。
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
取少量晶体于试管中,充分加热 | 试管内有固体剩余 |
|
|
| 固体全部溶解,有气泡产生 |
|
|
(5)若用(1)中得A制取丙,并用园底烧瓶通过排气法收集丙(标准状况),然后进行喷泉实验。当水进入到烧瓶体积得3/5时,液面不再上升,此时立即关闭止水夹,烧瓶内溶液中溶质的物质的量浓度是 mol/L(精确0.001)。 查看习题详情和答案>>
(1)实验室中可用下图A或B装置与相应的药品制得丙.
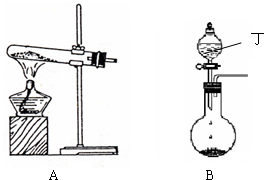
①A中试管内反应的化学方程式是
| ||
| ||
②B中分液漏斗内盛放的物质丁是
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
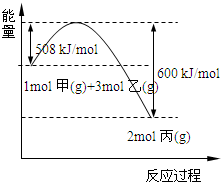
该反应的热化学方程式是
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是
| ||
| ||
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | 该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 | 该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |
(8分)已知由短周期元素组成的A、B、C、D四种常见化合物分子中所含原子数目依次为2、3、4、5,其中A、B含有18个电子,C、D含有10个电子。请回答:
(1)D中含有的化学键类型有 ,已知8gD与O2完全燃烧,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式 。
(2)室温下,若向一定量C的稀溶液中逐滴加入物质的量浓度相同的A,直至A过量,生成化合物XY4Z(X、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
|
|
离子浓度由大到小的顺序 |
溶质的化学式 |
溶液的pH |
|
I |
c(XY+4)>c(Z—)>c(OH—)>c(H+) |
|
pH>7 |
|
II |
c(XY+4)=c(Z—) |
XY4Z、XY3·H2O |
|
|
III |
|
XY4Z |
pH<7 |
|
IV |
c(Z—)>c(H+)>c(XY+4)> >c(OH—) |
|
pH<7 |
(3)B在空气中完全燃烧生成E,在一定条件下发生E与O2反应生成F。
①将0.05molE和0.03molO2放入容积为1L的密闭容器中,达到平衡,测得c(F)=0.04mol·L—1。计算该条件下反应的平衡常数K= 和E的平衡转化率 。
②已知上述反应是放热反应,当该反应处于平衡状态时,下列措施中有利于提高E平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
查看习题详情和答案>>
