摘要:N.M两种元素.已知N是短周期元素.且N2-与M+的电子数之差为8.则下列说法正确的是: ( ) A.N和M原子的电子总数之和可能为11 B.N和M的原子序数之差为8 C.N和M原子的最外层电子数之和为8 D.N和M原子的最外层电子数之差为7
网址:http://m.1010jiajiao.com/timu3_id_356481[举报]
已知:①短周期元素X、Y、M、N的离子半径大小关系为:Y+>X+、N2->Y+、M->N2-;②短周期主族元素中Y的原子半径与X的原子半径之比最大,X与M可形成化合物A。则:
(1)写元素符合:X________Y________M________N________。X的单质与M的单质反应每生成1 mol A 放出92.3 KJ热量,该反应的热化学方程式为_________________________。
(2)工业上常用电解Y和M形成的化合物的水溶液制得M的单质,则电解反应方程式为_____________________,M的单质可与另一电解产物反应生成两种盐B和C,且C中所含元素原子个数之比为1∶1∶3,则B__________C__________(填化学式)。
(3)C在酸性条件下可和草酸反应得到气体MN2,它是当前对饮用水进行消毒的一种较好的消毒剂,则上述反应的离子方程式为____________________________________________。
查看习题详情和答案>>A、B、X、Y、Z为短周期元素,它们的原子序数依次增大;A是自然界中组成化合物种类最多的元素之一:B元素的最高价氧化物对应的水化物与其简单氢化物反应生成一种盐G;元素A与Y同主族,且Y元素在短周期元素中的原子半径最大(不考虑稀有气体);Z元素的核电荷数是X的2倍.请回答下列问题:
(1)盐G的晶体内所含化学键类型是 ;在常温下测得该盐的某浓度溶液pH=6,则盐中的阴、阳离子在该溶液中的浓度之差的数值等于 (精确计算);
(2)将元素A与Z形成的化合物与过量NaOH反应生成物质F,F的水溶液在空气中长期放置发生反应,生成M和N两种物质,M与过氧化钠的结构和性质相似,则N的电子式为 ;
(3)有两种化合物同时含有上述元素中的四种相同元素,这两种化合物的水溶液混合后迅速反应,生成物中仍有一种含上述四种元素,写出该产物的化学式: ,该反应的离子方程式是 ;
(4)将由BX和BX2组成的混合气体通入下图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2).
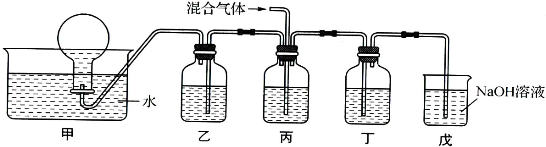
已知:①浓硝酸能将BX氧化成BX2,而稀硝酸不能氧化BX;
②NaOH溶液与BX2能发生反应生成两种盐和水,NaOH溶液与BX不反应.
a.装置乙、丙、丁中盛放的药品依次是 、 、 ;
b.能够说明实验已成功的现象是 .
查看习题详情和答案>>
(1)盐G的晶体内所含化学键类型是
(2)将元素A与Z形成的化合物与过量NaOH反应生成物质F,F的水溶液在空气中长期放置发生反应,生成M和N两种物质,M与过氧化钠的结构和性质相似,则N的电子式为
(3)有两种化合物同时含有上述元素中的四种相同元素,这两种化合物的水溶液混合后迅速反应,生成物中仍有一种含上述四种元素,写出该产物的化学式:
(4)将由BX和BX2组成的混合气体通入下图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2).

已知:①浓硝酸能将BX氧化成BX2,而稀硝酸不能氧化BX;
②NaOH溶液与BX2能发生反应生成两种盐和水,NaOH溶液与BX不反应.
a.装置乙、丙、丁中盛放的药品依次是
b.能够说明实验已成功的现象是
A、B、C、D、E为5种短周期元素,且原子序数依次增大.A的原子半径最小;B的电子总数与其最外层电子数之比为3:2;C的最高价氧化物对应水化物与其简单氢化物反应生成一种盐类物质甲.A、E同主族,A、B、C、E都能分别与D形成原子个数比不同的常见化合物.请回答下列问题:
(1)B在周期表中位于第 族,甲的名称是 .
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为 .在微电子工业中,M的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 .
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分.现取13.0g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6.72L)和一种固体单质,则乙的化学式是 .
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.汽车内燃机工作时引起反应:C2(g)+D2(g)?2CD(g),是导致汽车尾气中含有CD的原因之一.T℃时,向容积为2L的密闭容器中充入10molC2与5molD2,达到平衡后CD的物质的量为2mol,则T℃时该反应的平衡常数K= (计算结果保留两位有效数字).在其他条件不变的情况下,再通入10molC2与5moD2,达到平衡常数时C2的转化率将 (填“增大”、“减小”或“不变”,下同),CD的平衡浓度将 .
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
△H2= .
查看习题详情和答案>>
(1)B在周期表中位于第
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分.现取13.0g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6.72L)和一种固体单质,则乙的化学式是
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.汽车内燃机工作时引起反应:C2(g)+D2(g)?2CD(g),是导致汽车尾气中含有CD的原因之一.T℃时,向容积为2L的密闭容器中充入10molC2与5molD2,达到平衡后CD的物质的量为2mol,则T℃时该反应的平衡常数K=
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
△H2=
A、B、C、D、E为5种短周期元素,且原子序数依次增大。A的原子半径最小;B的电子总数与其最外层电子数之比为3:2;C的最高价氧化物对应水化物与其简单氢化物反应生成一种盐类物质甲。A、E同主族,A、B、C、E都能分别与D形成原子个数比不同的常见化合物。请回答下列问题:
(1)B在周期表中位于第______族,甲的名称是___________。
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为___________。在微电子工业中,M的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分。现取13.0 g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6. 72L)和一种同体单质,则乙的化学式是___________。
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。汽车内燃机工作时引起反应:C2(g)+D2(g)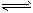 2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=
2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=
____________(计算结果保留两位有效数字)。在其他条件不变的情况下,再通入10mol C2与5 mol D2,达到新平衡时C2的转化率将____(填“增大”“减小”或“不变”,下同),CD的平衡浓度将____。
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ/mol
△H2=___________。
查看习题详情和答案>>
(1)B在周期表中位于第______族,甲的名称是___________。
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为___________。在微电子工业中,M的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分。现取13.0 g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6. 72L)和一种同体单质,则乙的化学式是___________。
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。汽车内燃机工作时引起反应:C2(g)+D2(g)
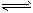 2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=
2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=____________(计算结果保留两位有效数字)。在其他条件不变的情况下,再通入10mol C2与5 mol D2,达到新平衡时C2的转化率将____(填“增大”“减小”或“不变”,下同),CD的平衡浓度将____。
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ/mol
△H2=___________。
(2011?太原二模)已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去).A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体.F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱.反应①是实验室检验某离子的方法,反应②是工业、生产N的重要反应.请回答下列问题: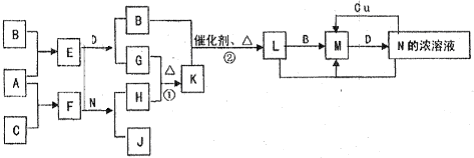
(1)B元素在元素周期表中的位置是
 .
.
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(请用上图所示关系中反应的化学方程式回答).
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法.亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO?bCr2O3等,统称为亚铬酸铜.
CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:
(5)已知一定温度(>100℃)下,反应②的平衡常数为1.将0.8mol K和1.1mol B放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正
查看习题详情和答案>>

(1)B元素在元素周期表中的位置是
第二周期第ⅥA族
第二周期第ⅥA族
,F的电子式是

(2)写出反应①的离子方程式:
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
| ||
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
NO+2HNO3(浓)═3NO2+H2O
NO+2HNO3(浓)═3NO2+H2O
(请用上图所示关系中反应的化学方程式回答).
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法.亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO?bCr2O3等,统称为亚铬酸铜.
CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:
2CuNH4(OH)CrO4
2CuO.Cr2O3+N2↑+5H2O
| ||
2CuNH4(OH)CrO4
2CuO.Cr2O3+N2↑+5H2O
.
| ||
(5)已知一定温度(>100℃)下,反应②的平衡常数为1.将0.8mol K和1.1mol B放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正
>
>
v逆(填“>”、“<”或“=”). 当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度增大
增大
(填“增大”、“不变”或“减小”),B的转化率降低
降低
.(填“升高”、“不变”或“降低”),L的体积分数无法确定
无法确定
(填“增大”、“不变”、“减小”或“无法确定”).