摘要:25℃时.将等体积甲酸溶液和苛性钠溶液混合后.若混和液中C(Na+)=C(HCOO-),则溶液的pH为: ( ) A.大于7 B.小于7 C.等于7 D.无法确定
网址:http://m.1010jiajiao.com/timu3_id_356468[举报]
甲、乙、丙均为可溶于水的固体,可能含有的离子如下表所示:
已知:
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体.
(1)甲、乙、丙的化学式分别为
(2)25℃时,pH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为 .
(3)写出⑤中发生反应的离子方程式
(4)25℃时,将a mol/L CH3COOH溶液与0.02mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)= (忽略混合时溶液体积的变化).
(5)等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该元素的质量相等,则乙溶液和丙溶液的体枳比可能为 (填选项字母).
A.3:1 B.1:3 C.7:1 D.1:7.
查看习题详情和答案>>
| 阳离子 | Na+、Mg2+、Fe3+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO32-、OH-、CO32-、SO42- |
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体.
(1)甲、乙、丙的化学式分别为
(2)25℃时,pH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为
(3)写出⑤中发生反应的离子方程式
(4)25℃时,将a mol/L CH3COOH溶液与0.02mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)=
(5)等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该元素的质量相等,则乙溶液和丙溶液的体枳比可能为
A.3:1 B.1:3 C.7:1 D.1:7.
CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸
(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),则该溶液中含有的溶质为
(4)已知Ka(CH3COOH)=1.76×10-5,Ka(HNO2)=4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者
(5)已知25℃时,0.1mol?L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
查看习题详情和答案>>
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸
>
>
醋酸(填“>”、“=”或“<”).(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈
碱
碱
性,原因CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
(用离子方程式表示).(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),则该溶液中含有的溶质为
CH3COOH和CH3COONa
CH3COOH和CH3COONa
.(4)已知Ka(CH3COOH)=1.76×10-5,Ka(HNO2)=4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者
>
>
后者(填“>,<或=”)(5)已知25℃时,0.1mol?L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
CH3COOH?CH3COO-+H+,因醋酸钠电离,使CH3COO-浓度增大,醋酸的电离平衡逆向移动,H+浓度下降,pH增大
CH3COOH?CH3COO-+H+,因醋酸钠电离,使CH3COO-浓度增大,醋酸的电离平衡逆向移动,H+浓度下降,pH增大
.25℃时,0.1mol?L-1的某酸HA溶液中
=1010,请回答下列问题:
(1)HA是
(2)在加水稀释HA的过程中,随着水量的增加而减小的是
A.
B.
C.c(H+)?c(OH-) D.c(OH-)
(3)向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2
A.HA多 B.盐酸多 C.二者一样多 D.无法判断
(4)将该HA溶液和0.1mol/LNaOH溶液按不同体积混合,所得混合溶液的pH如下表:
①请用“>”、“<”或“=”填写下列空白:
a
②用离子方程式表示甲组混合液pH=a的原因
③乙组混合液中各种离子浓度大小关系为
查看习题详情和答案>>
| c(H+) |
| c(OH-) |
(1)HA是
弱
弱
酸(填“强”或“弱”),写出其电离方程式HA?H++A-
HA?H++A-
.(2)在加水稀释HA的过程中,随着水量的增加而减小的是
B
B
(填字母).A.
| c(H+) |
| c(HA) |
| c(HA) |
| c(A-) |
(3)向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2
A
A
.A.HA多 B.盐酸多 C.二者一样多 D.无法判断
(4)将该HA溶液和0.1mol/LNaOH溶液按不同体积混合,所得混合溶液的pH如下表:
| 实验编号 | HA溶液体积(mL) | NaOH溶液体积(mL) | 混合溶液的pH |
| 甲 | 20.00 | 20.00 | a |
| 乙 | 20.00 | V | 7 |
| 丙 | 20.00 | 10.00 | <7 |
a
>
>
7;V<
<
20.00;丙组混合液中:c(HA)<
<
c(A-)②用离子方程式表示甲组混合液pH=a的原因
A-+H2O?HA+OH-
A-+H2O?HA+OH-
.③乙组混合液中各种离子浓度大小关系为
c(A-)=c(Na+)>c(H+)=c(OH-)
c(A-)=c(Na+)>c(H+)=c(OH-)
.图甲中A-J均为中学化学中常见的物质,A、H是短周期元素组成的常见气体单质,B是日常生活常见金属,它们之间有如下转化关系(反应中生成的水及部分生成物已略去).请回答以下问题:
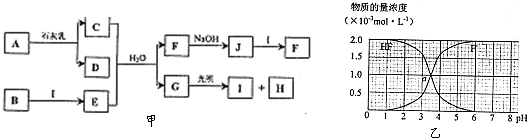
(1)D的电子式是 ,G的结构式是 ;
(2)C的水溶液显 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示);
(3)写出J+I→F的离子方程式: ;
(4)在298K,100kPa时,在1L水中可溶解0.09mol A,实验测得溶于水的A约有
与水反应,请估算该离子反应的平衡常数K= ;(忽略溶液体积变化)
(5)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到(HF)、c(F-)与溶液pH的变化关系如图乙.若将4.0×10-3mol?L-1HF溶液与4.0×10-3mol?L-1CaCl2溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10].
查看习题详情和答案>>

(1)D的电子式是
(2)C的水溶液显
(3)写出J+I→F的离子方程式:
(4)在298K,100kPa时,在1L水中可溶解0.09mol A,实验测得溶于水的A约有
| 1 | 3 |
(5)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到(HF)、c(F-)与溶液pH的变化关系如图乙.若将4.0×10-3mol?L-1HF溶液与4.0×10-3mol?L-1CaCl2溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10].
物质的转化关系如图1所示(有的反应可能在水溶液中进行).其中甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成.请回答下列问题:

请回答些列问题:
(1)写出甲的电子式是
 .
.
(2)写出反应Ⅰ的化学方程式
(3)A溶于水得到得到溶液X,在25℃下,将a mol?L-1的X与b mol?L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过如图2装置处理污水.
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是
查看习题详情和答案>>

请回答些列问题:
(1)写出甲的电子式是


(2)写出反应Ⅰ的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)A溶于水得到得到溶液X,在25℃下,将a mol?L-1的X与b mol?L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为
c(NO3-)=c(NH4+)>c(OH-)=c(H+)
c(NO3-)=c(NH4+)>c(OH-)=c(H+)
用含a和b的代数式表示出该混合溶液中X的电离平衡常数k=
| b×10-7 |
| a-b |
k=
.| b×10-7 |
| a-b |
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过如图2装置处理污水.
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ.
Al-3e-=Al3+
Al-3e-=Al3+
;Ⅱ.4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是
CO2
CO2
.