题目内容
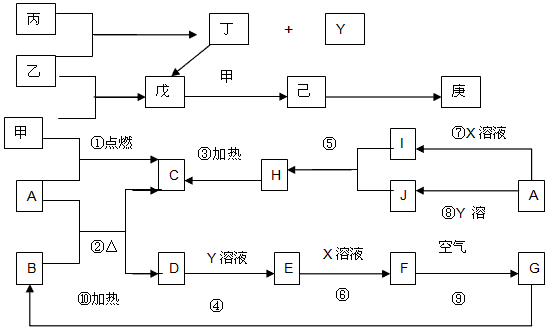
图甲中A-J均为中学化学中常见的物质,A、H是短周期元素组成的常见气体单质,B是日常生活常见金属,它们之间有如下转化关系(反应中生成的水及部分生成物已略去).请回答以下问题:
(1)D的电子式是 ,G的结构式是 ;
(2)C的水溶液显 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示);
(3)写出J+I→F的离子方程式: ;
(4)在298K,100kPa时,在1L水中可溶解0.09mol A,实验测得溶于水的A约有
与水反应,请估算该离子反应的平衡常数K= ;(忽略溶液体积变化)
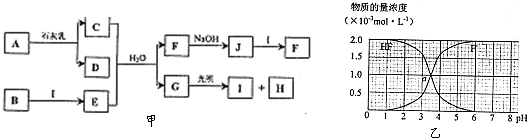
(5)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到(HF)、c(F-)与溶液pH的变化关系如图乙.若将4.0×10-3mol?L-1HF溶液与4.0×10-3mol?L-1CaCl2溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10].

(1)D的电子式是
(2)C的水溶液显
(3)写出J+I→F的离子方程式:
(4)在298K,100kPa时,在1L水中可溶解0.09mol A,实验测得溶于水的A约有
| 1 | 3 |
(5)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到(HF)、c(F-)与溶液pH的变化关系如图乙.若将4.0×10-3mol?L-1HF溶液与4.0×10-3mol?L-1CaCl2溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10].
分析:A是短周期元素组成的常见气体单质,且能和石灰乳反应,则A是Cl2,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,B是日常生活常见金属,能和I反应生成E,E能和C的水溶液发生反应,则该金属应该为变价金属,所以是Fe,I是化合物,应该是酸,E是亚铁盐,能被次氯酸钙氧化,则C是Ca(ClO)2,D是CaCl2,C和E反应生成铁盐和G,G在光照条件下能反应生成I和H,H是短周期元素组成的常见气体单质,根据元素守恒知,G是HClO,H是O2,I是HCl,所以E是AlCl3,J是NaAl2,结合物质的结构和性质分析解答.
解答:解:A是短周期元素组成的常见气体单质,且能和石灰乳反应,则A是Cl2,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,B是日常生活常见金属,能和I反应生成E,E能和C的水溶液发生反应,则该金属应该为变价金属,所以是Fe,I是化合物,应该是酸,E是亚铁盐,能被次氯酸钙氧化,则C是Ca(ClO)2,D是CaCl2,C和E反应生成铁盐和G,G在光照条件下能反应生成I和H,H是短周期元素组成的常见气体单质,根据元素守恒知,G是HClO,H是O2,I是HCl,所以E是AlCl3,J是NaAl2,
(1)D是氯化钙,氯化钙的电子式是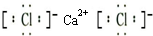 ,G是次氯酸,次氯酸分子的中心原子是O原子,次氯酸分子的结构式是H-O-Cl,
,G是次氯酸,次氯酸分子的中心原子是O原子,次氯酸分子的结构式是H-O-Cl,
故答案为: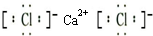 ;H-O-Cl;
;H-O-Cl;
(2)C是次氯酸钙,次氯酸钙是强碱弱酸盐,次氯酸根离子易水解而使其水溶液呈碱性,离子反应为ClO-+H2O?HClO+OH-,
故答案为:碱性;ClO-+H2O?HClO+OH-;
(3)J是偏铝酸钠,I是HCl,偏铝酸钠和盐酸反应生成氢氧化铝和氯化钠,离子反应方程式为AlO2-+H++H2O=Al(OH)3,故答案为:AlO2-+H++H2O=Al(OH)3;
(4)在298K,100kPa时,在1L水中可溶解0.09molA,实验测得溶于水的A约有
与水反应,氯气和水反应离子方程式为:Cl2+H2O?H++Cl-+HClO,平衡常数K=
=4.5×10-4,故答案为:4.5×10-4;
(5)根据图知,当pH=4时,溶液中c(F-)=1.6×10-3mol/L,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成,
答:当pH=4时,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成.
(1)D是氯化钙,氯化钙的电子式是
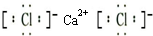 ,G是次氯酸,次氯酸分子的中心原子是O原子,次氯酸分子的结构式是H-O-Cl,
,G是次氯酸,次氯酸分子的中心原子是O原子,次氯酸分子的结构式是H-O-Cl,故答案为:
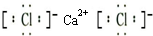 ;H-O-Cl;
;H-O-Cl;(2)C是次氯酸钙,次氯酸钙是强碱弱酸盐,次氯酸根离子易水解而使其水溶液呈碱性,离子反应为ClO-+H2O?HClO+OH-,
故答案为:碱性;ClO-+H2O?HClO+OH-;
(3)J是偏铝酸钠,I是HCl,偏铝酸钠和盐酸反应生成氢氧化铝和氯化钠,离子反应方程式为AlO2-+H++H2O=Al(OH)3,故答案为:AlO2-+H++H2O=Al(OH)3;
(4)在298K,100kPa时,在1L水中可溶解0.09molA,实验测得溶于水的A约有
| 1 |
| 3 |
| ||||||||
|
(5)根据图知,当pH=4时,溶液中c(F-)=1.6×10-3mol/L,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成,
答:当pH=4时,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成.
点评:本题考查了无机物的推断,涉及溶度积常数的计算、电离平衡常数的计算、电子式的书写等知识点,难点是否有沉淀的判断,注意氢氟酸和氯化钙溶液混合时,溶液体积增大一倍,为易错点.

练习册系列答案
相关题目