题目内容
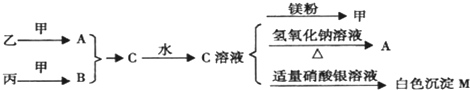
甲、乙、丙均为可溶于水的固体,可能含有的离子如下表所示:
已知:
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体.
(1)甲、乙、丙的化学式分别为
(2)25℃时,pH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为 .
(3)写出⑤中发生反应的离子方程式
(4)25℃时,将a mol/L CH3COOH溶液与0.02mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)= (忽略混合时溶液体积的变化).
(5)等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该元素的质量相等,则乙溶液和丙溶液的体枳比可能为 (填选项字母).
A.3:1 B.1:3 C.7:1 D.1:7.
| 阳离子 | Na+、Mg2+、Fe3+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO32-、OH-、CO32-、SO42- |
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体.
(1)甲、乙、丙的化学式分别为
(2)25℃时,pH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为
(3)写出⑤中发生反应的离子方程式
(4)25℃时,将a mol/L CH3COOH溶液与0.02mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)=
(5)等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该元素的质量相等,则乙溶液和丙溶液的体枳比可能为
A.3:1 B.1:3 C.7:1 D.1:7.
分析:①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性,则甲、乙可为碱或水解呈碱性的物质,丙一定为水解呈酸性的盐;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液,则一定不含Fe3+,所以丙一定含有Al3+,可能为AlCl3 或Al2(SO4)3;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出,该气体为CO2;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成,则丙应为Al2(SO4)3;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体,则甲与丙应发生互促水解反应,甲为Na2CO3,所以乙为NaOH,
结合对应物质的性质以及题目要求可解答该题.
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液,则一定不含Fe3+,所以丙一定含有Al3+,可能为AlCl3 或Al2(SO4)3;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出,该气体为CO2;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成,则丙应为Al2(SO4)3;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体,则甲与丙应发生互促水解反应,甲为Na2CO3,所以乙为NaOH,
结合对应物质的性质以及题目要求可解答该题.
解答:解:①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性,则甲、乙可为碱或水解呈碱性的物质,丙一定为水解呈酸性的盐;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液,则一定不含Fe3+,所以丙一定含有Al3+,可能为AlCl3 或Al2(SO4)3;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出,该气体为CO2;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成,则丙应为Al2(SO4)3;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体,则甲与丙应发生互促水解反应,甲为Na2CO3,所以乙为NaOH,
(1)由以上分析可知甲为Na2CO3,乙为NaOH,丙为Al2(SO4)3,
故答案为:Na2CO3、NaOH、Al2(SO4)3;
(2)碳酸钠水解,促进水的电离,NaOH抑制水的电离,则pH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为10-2:10-12=1:10-10,
故答案为:1:10-10;
(3)⑤中发生反应为互促水解反应,反应的离子方程式为2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑;
(4)将a mol/L CH3COOH溶液与0.02mol/LNaOH溶液等体积混合,所得溶液呈中性,根据电荷守恒可知c(CH3COO-)=c(Na+)=0.01mol/L,
故答案为:0.01mol/L;
(5)等物质的量浓度的NaOH溶液和Al2(SO4)3 溶液混合充分反应后,沉淀中的金属元素与溶液中该元素的质量相等,溶液的离子可能为Al3+或AlO2-,
如生成Al3+,则发生Al3++3OH-═Al(OH)3↓,
设NaOH的体积为x,Al2(SO4)3 的体积为y,
则3y=x,
x:y=3:1,
如生成AlO2-,则发生Al3++3OH-═Al(OH)3↓,Al3++4OH-═AlO2-+2H2O,
3y+4y=x,
x:y=7:1,
故答案为:AC.
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液,则一定不含Fe3+,所以丙一定含有Al3+,可能为AlCl3 或Al2(SO4)3;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出,该气体为CO2;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成,则丙应为Al2(SO4)3;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体,则甲与丙应发生互促水解反应,甲为Na2CO3,所以乙为NaOH,
(1)由以上分析可知甲为Na2CO3,乙为NaOH,丙为Al2(SO4)3,
故答案为:Na2CO3、NaOH、Al2(SO4)3;
(2)碳酸钠水解,促进水的电离,NaOH抑制水的电离,则pH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为10-2:10-12=1:10-10,
故答案为:1:10-10;
(3)⑤中发生反应为互促水解反应,反应的离子方程式为2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑;
(4)将a mol/L CH3COOH溶液与0.02mol/LNaOH溶液等体积混合,所得溶液呈中性,根据电荷守恒可知c(CH3COO-)=c(Na+)=0.01mol/L,
故答案为:0.01mol/L;
(5)等物质的量浓度的NaOH溶液和Al2(SO4)3 溶液混合充分反应后,沉淀中的金属元素与溶液中该元素的质量相等,溶液的离子可能为Al3+或AlO2-,
如生成Al3+,则发生Al3++3OH-═Al(OH)3↓,
设NaOH的体积为x,Al2(SO4)3 的体积为y,
则3y=x,
x:y=3:1,
如生成AlO2-,则发生Al3++3OH-═Al(OH)3↓,Al3++4OH-═AlO2-+2H2O,
3y+4y=x,
x:y=7:1,
故答案为:AC.
点评:本题考查较为综合,涉及物质的检验、鉴别、盐类的水解、混合物的计算等,综合考查学生的分析能力和计算能力,为高考常见题型,难度中等,明确物质的种类为解答该题的关键.

练习册系列答案
相关题目