网址:http://m.1010jiajiao.com/timu3_id_356284[举报]
Al2O3+3C+N2
| 高温 |
(问题探究)某化学研究性学习小组成员根据氮化铝的制取原理,进行了如下探究.
问题1、在制取氮化铝时由于反应不完全,氮化铝产品中所含杂质除了碳以外还可能存在
问题2、为测定该产品中有关成分的含量,甲、乙两同学设计了以下两个实验:
(1)甲同学:称取10.00g样品,将其加入过量的氢氧化钠溶液中共热并蒸干,AlN跟氢氧化钠溶液反应生成NaAlO2,并放出氨气3.36L(标准状况).
①上述反应的化学方程式为
②该样品中的AlN的质量分数为
(2)乙同学:称取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g?L-1(已折成标准状况,AlN不跟O2反应).该样品中含杂质碳
问题3、丙同学受到甲、乙同学实验的启发,认为测定某氮化铝中含有碳或氧化铝杂质,可用图中I的一些装置来进行检验,根据AlN与NaOH溶液反应所生成氨气的体积来测定样品中氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
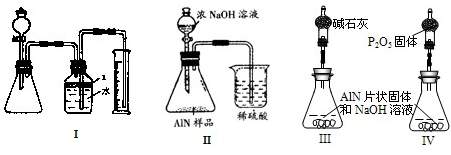
(1)实验有关操作为:①往锥形瓶中放入适量的AlN样品:②从分液漏斗往锥形瓶中加入过量的浓NaOH;③检验装置的气密性;④测定收集到水的体积.
正确的操作顺序为
(2)本试验中检查装置气密性的方法是
(3)广口瓶中的试剂X可最好选用
A、苯 B、酒精 C、植物油 D、CCl4
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将
(5)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为
| 4100a |
| 22.4w |
| 4100a |
| 22.4w |
(6)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
问题4、丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大.建议改用图9中的Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行?
问题5、戊同学仔细思考了丁同学的装置后,认为此装置所测测得的样品中AlN含量偏小.其原因是
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 ▲ 极 (填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
查看习题详情和答案>>
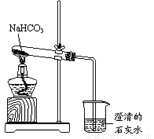
(10分)实验室利用右图所示装置进行NaHCO3的受热分解实验。请回答:
(1)加热一段时间后,烧杯中观察到的实验现象是 。
(2)实验结束时的正确操作是 ;理由是 。
(3)NaHCO3受热分解的化学方程式: 。
(4)33.6gNaHCO3受热分解放出气体在标况下的体积
(10分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用带刻度的集气瓶排水法收集氢气,每隔1分钟记录一次数据(累计值):
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)从0~3分钟时间段内,产生氢气的速率是如何变化的?答:___________________ ,造成这种变化的主要因素是____________;从3~5分钟时间段内,产生氢气的速率是如何变化的?
答:_________________,造成这种变化的主要因素是_________________。
(2)在盐酸中分别加入等体积的下列溶液,能减缓反应速率而又不减少产生氢气的量的是__________(双选题,漏选得1分,多选错选得0分)。
A.蒸馏水 B.CuSO4溶液 C.Na2CO3溶液 D.NaCl溶液
(3)在0~1、1~2、2~3、3~4、4~5分钟五个时间段中,反应速率最大的是在 分钟时间段内,在该时间段内盐酸的反应速率为 mol·L-1 min-1(设溶液体积不变,上述气体体积为标况下数据)。
查看习题详情和答案>>