题目内容
 A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:
A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:(1)C与A形成的最简单分子是
(2 )在由A、B两元素形成的一系列化合物中,若要求所有的原子都有可能在同一个平面中,则对B原子成键轨道的要求是
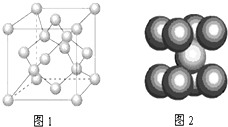
(3)一定条件下,元素B可形成多种同素异形体,它们有的属原子晶体、有的属分子晶体、有的属混合型晶体,如图1是其中某种晶体的一个晶胞,该晶胞中含有
(4)如图2为晶体D的晶胞结构,若D原子的半径为r cm,NA为阿伏加德罗常数的值,则晶体D的密度为
(1)C与A形成的最简单分子为NH3,为三角锥型,正负电荷重心不重合,属于极性分子;NH3与H+结合成新的离子NH4+时,NH3中有一对孤对电子,当孤对电子与H+结合形成配位键形成NH4+后,孤对电子成为成键电子,四个键等同,斥力也等同,成为正四面体,所以HNH键的键角就变为109°28′,
故答案为:极性;NH3中有一对孤对电子,当孤对电子与H+结合形成配位键形成NH4+后,孤对电子成为成键电子,四个键等同,斥力也等同,成为正四面体,所以HNH键的键角就变为109°28′;
(2 )在由H、C两元素形成的一系列化合物为烃,若要求所有的原子都有可能在同一个平面中,为平面结构或直线型结构,则B原子不能有sp3杂化轨道,只能有sp和sp2杂化轨道,
故答案为:B原子不能有sp3杂化轨道,只能有sp和sp2杂化轨道;
(3)一定条件下,碳元素可形成多种同素异形体,它们有的属原子晶体、有的属分子晶体、有的属混合型晶体,如图1是其中某种晶体的一个晶胞,该晶胞中4个C原子位于晶胞内部、6个C原子位于面心、8个C原子位于顶点上,故该晶胞中含有C原子数目=4+6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:8;原子晶体是原子之间是以共价键结合的,共价键有饱和性和方向性,一个原子不能形成12条共价键,所以原子晶体不能形成配位数是12的最密堆积结构;
(4)图2为晶体Fe的晶胞结构,为体心立方堆积,晶胞中Fe原子数目=1+8×
| 1 |
| 8 |
| 2×56 |
| NA |
4
| ||
| 3 |
4
| ||
| 3 |
64
| ||
| 9 |
| ||||
|
21
| ||
| 4NAr3 |
故答案为:
21
| ||
| 4NAr3 |

(14分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。

(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(3)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的18电子的X分子的结构式为 ;该元素还可与元素①形成10电子的气体分子Y ,将过量的Y气体通入盛有硝酸银水溶液的试管里,发生化学反应所对应的离子方程式为
。
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。
|
电离能I(eV) |
A |
B |
C |
D |
E |
F |
|
I1[来源:学&科&网] |
11.3 |
14.5 |
13.6 |
5.2 |
7.6 |
6.0 |
|
I2 |
24.4 |
29.6 |
35.1 |
49.3 |
15.0 |
18.8 |
|
I3 |
47.9 |
47.4 |
54.9 |
71.6 |
80.1 |
28.4 |
|
I4 |
64.5 |
77.5 |
77.4 |
98.9 |
109.2 |
112.0 |
|
I5 |
392.1 |
97.9 |
113.9 |
138.3 |
141.3 |
153.7 |
请回答:表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是 。










