摘要:18.(Ⅰ)A.B均是盐.由A溶液和B溶液出发.可发生下图所示的一系列变化 根据实验.回答有关问题: (1)写出反应④和⑥的离子方程式 (2)写出A和B的化学式A ,B . (Ⅱ)向100mL 3mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入 1mol·L-1Ba(OH)2溶液. (1)写出当刚好出现沉淀物质的量总量的最大值时的离子方程式: . 2溶液体积的变化.沉淀总物质的量的变化如右图所示(Y代表沉淀总物质的量/mol,X代表Ba(OH)2溶液体积/mL).写出B点和C点所对应的Ba(OH)2溶液的体积:B .C .
网址:http://m.1010jiajiao.com/timu3_id_355220[举报]
(2002·北京)A、B均是盐,由A溶液和B溶液出发,可发生图所示的一系列变化(各步所加试剂均足量):
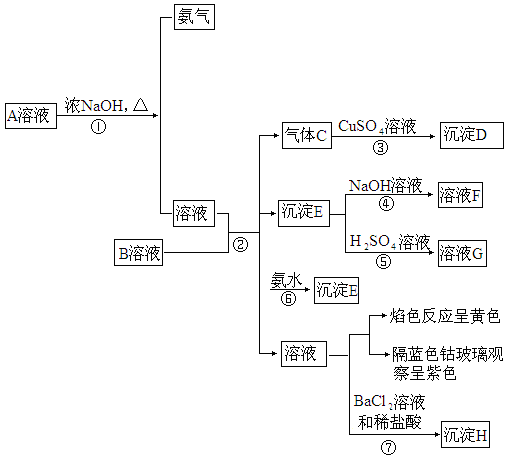
根据实验,回答有关问题:
(1)写出反应④和⑥的离子方程式:
反应④_______________________;
反应⑥_______________________.
(2)写出A和B的化学式:A________,B________.
查看习题详情和答案>>A、B、C、D、E为中学化学常见的单质或化合物,它们之间的相互转化关系如图所示(部分产物略去).

请回答下列问题:
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,C、D均为空气的主要成分,E是一种有毒气体.
①C分子的电子式为
 :
:
②写出反应I的化学方程式:
③写出反应Ⅱ的化学方程式:
(2)若A是淡黄色固体化合物;常温下D是无色气体;C分子中含有的阴、阳离子均为10电子粒子.
①D的结构式为
②写出反应I的化学方程式:
③写出反应Ⅱ的化学方程式:
(3)将(2)中一定量的气体D通入2L含C的溶液中,在反应后所得的溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).

①O点溶液中所含溶质的化学式为
②标准状况下,通入气体D的体积为
查看习题详情和答案>>

请回答下列问题:
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,C、D均为空气的主要成分,E是一种有毒气体.
①C分子的电子式为


②写出反应I的化学方程式:
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;
| ||
| △ |
③写出反应Ⅱ的化学方程式:
2NO+2CO
N2+2CO2
| ||
2NO+2CO
N2+2CO2
.
| ||
(2)若A是淡黄色固体化合物;常温下D是无色气体;C分子中含有的阴、阳离子均为10电子粒子.
①D的结构式为
O=C=O
O=C=O
,C分子中所含化学键的类型是离子键和共价键
离子键和共价键
;②写出反应I的化学方程式:
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
;③写出反应Ⅱ的化学方程式:
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(3)将(2)中一定量的气体D通入2L含C的溶液中,在反应后所得的溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).

①O点溶液中所含溶质的化学式为
NaHCO3、NaOH
NaHCO3、NaOH
,常温下a点溶液的pH>
>
7(填“>”、“=”或“<”),a点溶液中各离子浓度由大到小的关系是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
;②标准状况下,通入气体D的体积为
44.8
44.8
L,C溶液的物质的量浓度为2.5
2.5
mol?L-1.A、B、C、D、E 五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,E原子的电子层数等于最外层电子数,D的原子序数小于E.请用化学用语回答相关问题:
(1)A元素在周期表中的位置
(2)比较C和E简单离子半径大小:
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体.
①若甲的电子数与CH3OH相同,则甲的分子式为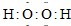
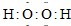 .
.
②乙的分子式为B2D4,乙和丙常作火箭推进器的燃料,反应后的产物无污染.已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式:
查看习题详情和答案>>
(1)A元素在周期表中的位置
第二周期ⅣA族
第二周期ⅣA族
.(2)比较C和E简单离子半径大小:
O2->Al3+
O2->Al3+
.(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):
A1O2-+2H2O?Al(OH)3+OH-
A1O2-+2H2O?Al(OH)3+OH-
;| X | Y | Z |
| 甲 | 乙 | 丙 |
①若甲的电子数与CH3OH相同,则甲的分子式为
C2H6
C2H6
;丙的电子式为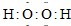
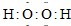
②乙的分子式为B2D4,乙和丙常作火箭推进器的燃料,反应后的产物无污染.已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式:
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.40kJ/mol
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.40kJ/mol
.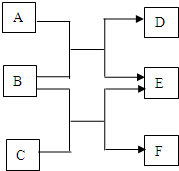 A、B、C、D、E、F六种物质均是由短周期元素组成的中学常见的化学物质.它们之间的转化关系如下图.
A、B、C、D、E、F六种物质均是由短周期元素组成的中学常见的化学物质.它们之间的转化关系如下图.(1)若A、C、E均为氧化物,且E为有毒气体,B、D、F均为非金属单质,且D为气体,则:
①F的晶体类型为
原子晶体
原子晶体
; 1molC中含有4
4
mol共价键;②B与C反应生成E和F的化学方程式为
2C+SiO2
Si+2CO
| ||
2C+SiO2
Si+2CO
| ||
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中A的相对分子质量最小;D、E、F皆为氧化物,且D、F皆为有毒气体.则:
①A、C、E三种氢化物沸点从高到低的顺序为
H2O>NH3>H2S
H2O>NH3>H2S
(填化学式);②A和F在水溶液中充入O2充分反应生成一种正盐,该反应的化学方程式为
2SO2+4NH3+2H2O+O2=2(NH4)2SO4
2SO2+4NH3+2H2O+O2=2(NH4)2SO4
(3)若B是由短周期元素组成的离子化合物,A、C为氧化物,E为气体单质,D、F是均有三种元素组成的离子化合物,它们的水溶液均呈碱性,相同浓度时D溶液的pH大于F.
①写出B的电子式


②B和C反应生成E和F的化学方程式
2Na2O2+2CO2=Na2CO3+O2
2Na2O2+2CO2=Na2CO3+O2
,列举该反应的一种用途呼吸面具和潜水艇中做为氧气的来源
呼吸面具和潜水艇中做为氧气的来源
.