网址:http://m.1010jiajiao.com/timu3_id_355158[举报]
①A元素原子最外层电子数是次外层电子数的2倍,且A与D同主族;
②B元素最高正价与负价的代数和为2;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物;
④B、C两种元素质子数之和是A元素质子数的4倍.
(1)A、B、C三种元素最高价氧化物对应水化物的酸(碱)性由强到弱的顺序是(用化学式表示)
(2)B的最高价氧化物的水化物的稀溶液与铜单质反应,离子方程为
(3)B、D两元素可形成一种新型无机非金属化合物材料X.X可由C、D两元素形成的化合物Z与B的氢化物在一定条件下制得,则生成X的化学方程为
(4)由B、C两种元素组成的化合物Y,常温下为易挥发的淡黄色液体,Y分子为三角锥形分子,且B、C两种原子最外层均达到8个电子的稳定结构.Y遇水蒸气可生成一种常见的漂白性物质.则Y的电子式为


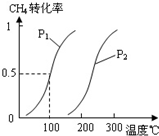 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式:
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g).将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1
③在其它条件不变的情况下降低温度,逆反应速率将
(3)由A、C、D元素原子组成的化合物N2H4和H2O2有广泛的用途.
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.电池放电时,负极的电极反应式为
②已知:16g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75KJ的热量.
H2O(1)=H2O(g)△H=+44kJ?mol-1
2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1
写出N2H4(肼)与氧气反应的热化学方程式为
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
(1)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式_______________________________________。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_______________________________________。
(4)化学反应![]() 2CA3(g)。
2CA3(g)。
当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是________________________。温度为T ℃时,将

(5)化合物A8B4D2有如下转化关系:

其中,g是常用调味品的主要成分。写出反应①的化学方程式__________________________。
设计实验方案完成d→e的转化____________________________________________________。
查看习题详情和答案>>
(1)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是______________________________。
(2)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应②的离子方程式是______________________________;在反应③中,若转移的电子数目为0.1 mol,则生成的D在标准状况下的体积为____________L。
(3)若反应①②③均为水溶液中的反应,A、D、E为ⅦA族元素的单质,则A、D、E的氧化性由强到弱的顺序为___________,其中A的化学式为___________。B、C、F呈固态时为___________(填“分子晶体”“离子晶体”或“原子晶体”),如B、C、F为气态氢化物时,则B、C、F分子的热稳定性由强到弱的顺序为___________。
查看习题详情和答案>>A、B、C、D均为短周期元素。A、B可形成两种液态化合物甲和乙,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与乙分子中的电子数相等,Y分子与甲分子中的电子数相等。请回答:
(1)A元素为 ,甲的电子式为 。
(2)常温下,pH为a的Y溶液与pH为b的氢氧化钠溶液按体积比1∶10混合后,正好完全反应,则a与b的关系为 。
(3)已知X在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子,请写出它电离方程式: 。
(4)将X和Y的稀溶液按某种比例混合,
①若所得溶液中只含一种溶质,则该溶质是 ,溶液中离子浓度的大小顺序为 ;
②若该溶液是由体积相等的X和Y溶液混合而成,且恰好呈中性,则混合前c(X) c(Y),混合前酸中c(H+)和碱中c(OH-)的关系c(H+) c(OH-)(填“大于”、“等于”、“小于”)。
查看习题详情和答案>>