题目内容
A、B、C、D是中学化学常见的四种短周期元素,已知:
①A元素原子最外层电子数是次外层电子数的2倍,且A与D同主族;
②B元素最高正价与负价的代数和为2;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物;
④B、C两种元素质子数之和是A元素质子数的4倍.
(1)A、B、C三种元素最高价氧化物对应水化物的酸(碱)性由强到弱的顺序是(用化学式表示)
(2)B的最高价氧化物的水化物的稀溶液与铜单质反应,离子方程为
(3)B、D两元素可形成一种新型无机非金属化合物材料X.X可由C、D两元素形成的化合物Z与B的氢化物在一定条件下制得,则生成X的化学方程为
(4)由B、C两种元素组成的化合物Y,常温下为易挥发的淡黄色液体,Y分子为三角锥形分子,且B、C两种原子最外层均达到8个电子的稳定结构.Y遇水蒸气可生成一种常见的漂白性物质.则Y的电子式为
 ,Y与水反应产物的化学式为
,Y与水反应产物的化学式为
①A元素原子最外层电子数是次外层电子数的2倍,且A与D同主族;
②B元素最高正价与负价的代数和为2;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物;
④B、C两种元素质子数之和是A元素质子数的4倍.
(1)A、B、C三种元素最高价氧化物对应水化物的酸(碱)性由强到弱的顺序是(用化学式表示)
HClO4>HNO3>H2CO3
HClO4>HNO3>H2CO3
,D元素在元素周期表中的位置是第三周期ⅣA族
第三周期ⅣA族
(2)B的最高价氧化物的水化物的稀溶液与铜单质反应,离子方程为
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
,现有19.2g 铜粉溶解,产生标准状况下气体的体积是4.48
4.48
L.(3)B、D两元素可形成一种新型无机非金属化合物材料X.X可由C、D两元素形成的化合物Z与B的氢化物在一定条件下制得,则生成X的化学方程为
3SiCl4+4NH3═Si3N4+12HCl
3SiCl4+4NH3═Si3N4+12HCl
.(4)由B、C两种元素组成的化合物Y,常温下为易挥发的淡黄色液体,Y分子为三角锥形分子,且B、C两种原子最外层均达到8个电子的稳定结构.Y遇水蒸气可生成一种常见的漂白性物质.则Y的电子式为


NH3和HClO
NH3和HClO
.分析:A、B、C、D是中学化学常见的四种短周期元素,
①A元素原子最外层电子数是次外层电子数的2倍,则A有2个电子层,最外层电子数为4,故A为碳元素,A与D同主族,故D为硅元素;
②B元素最高正价与负价的代数和为2,则B最外层电子数为5,处于周期表ⅤA族;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物,则C为氯元素;
④B、C两种元素质子数之和是A元素质子数的4倍,则B的质子数为24-17=7,符合题意,故B为氮元素.
①A元素原子最外层电子数是次外层电子数的2倍,则A有2个电子层,最外层电子数为4,故A为碳元素,A与D同主族,故D为硅元素;
②B元素最高正价与负价的代数和为2,则B最外层电子数为5,处于周期表ⅤA族;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物,则C为氯元素;
④B、C两种元素质子数之和是A元素质子数的4倍,则B的质子数为24-17=7,符合题意,故B为氮元素.
解答:解:A、B、C、D是中学化学常见的四种短周期元素,
①A元素原子最外层电子数是次外层电子数的2倍,则A有2个电子层,最外层电子数为4,故A为碳元素,A与D同主族,故D为硅元素;
②B元素最高正价与负价的代数和为2,则B最外层电子数为5,处于周期表ⅤA族;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物,则C为氯元素;
④B、C两种元素质子数之和是A元素质子数的4倍,则B的质子数为24-17=7,符合题意,故B为氮元素.
故A为碳元素,B为氮元素,C为氯元素,D为硅元素;
(1)A为碳元素,B为氮元素,C为氯元素,三种元素最高价氧化物对应水化物分别为HNO3、H2CO3、HClO4,非金属性Cl>N>C,所以酸性HClO4>HNO3>H2CO3;D为硅元素,原子核外有14个电子,有3个电子层,最外层电子数为4,位于周期表中第三周期ⅣA族.
故答案为:HClO4>HNO3>H2CO3;第三周期ⅣA族.
(2)B为氮元素,B的最高价氧化物的水化物为HNO3,HNO3的稀溶液与铜单质反应,生成硝酸铜与一氧化氮、水,反应离子方程为3Cu+8 H++2NO3-═3Cu2++2NO↑+4H2O;现有19.2g铜粉溶解,铜的物质的量为
=0.3mol,由离子方程式可知,生成NO为0.2mol,标准状况下NO的体积是 0.2mol×22.4L/L=4.48L.
故答案为:3Cu+8 H++2NO3-═3Cu2++2NO↑+4H2O;4.48.
(3)B为氮元素,D为硅元素;两元素可形成一种新型无机非金属化合物材料X,X为Si3N4,C为氯元素,C、D两元素形成的化合物Z为SiCl4,B的氢化物为NH3;Si3N4可由SiCl4与NH3在一定条件下制得,
反应方程式为3SiCl4+4NH3═Si3N4+12HCl.
故答案为:3SiCl4+4NH3═Si3N4+12HCl.
(4)B为氮元素,C为氯元素,两种元素组成的化合物Y,在常温下为易挥发的淡黄色液体,Y分子为三角锥形分子,且B、C两种原子最外层均达到8个电子的稳定结构,Y为NCl3,NCl3中氮原子与氯原子之间形成1对共用电子对,电子式为 ;NCl3遇水蒸气可生成一种常见的漂白性物质,该物质为HClO,NCl3中Cl原子结合水中的-OH,N原子结合H原子生成NH3,所以NCl3与水反应产物的化学式为 NH3和HClO.
;NCl3遇水蒸气可生成一种常见的漂白性物质,该物质为HClO,NCl3中Cl原子结合水中的-OH,N原子结合H原子生成NH3,所以NCl3与水反应产物的化学式为 NH3和HClO.
故答案为: ;NH3和HClO.
;NH3和HClO.
①A元素原子最外层电子数是次外层电子数的2倍,则A有2个电子层,最外层电子数为4,故A为碳元素,A与D同主族,故D为硅元素;
②B元素最高正价与负价的代数和为2,则B最外层电子数为5,处于周期表ⅤA族;
③C元素有多种化合价,且常温下C元素的气态单质与NaOH溶液反应,可得两种含C元素的化合物,则C为氯元素;
④B、C两种元素质子数之和是A元素质子数的4倍,则B的质子数为24-17=7,符合题意,故B为氮元素.
故A为碳元素,B为氮元素,C为氯元素,D为硅元素;
(1)A为碳元素,B为氮元素,C为氯元素,三种元素最高价氧化物对应水化物分别为HNO3、H2CO3、HClO4,非金属性Cl>N>C,所以酸性HClO4>HNO3>H2CO3;D为硅元素,原子核外有14个电子,有3个电子层,最外层电子数为4,位于周期表中第三周期ⅣA族.
故答案为:HClO4>HNO3>H2CO3;第三周期ⅣA族.
(2)B为氮元素,B的最高价氧化物的水化物为HNO3,HNO3的稀溶液与铜单质反应,生成硝酸铜与一氧化氮、水,反应离子方程为3Cu+8 H++2NO3-═3Cu2++2NO↑+4H2O;现有19.2g铜粉溶解,铜的物质的量为
| 19.2g |
| 64g/mol |
故答案为:3Cu+8 H++2NO3-═3Cu2++2NO↑+4H2O;4.48.
(3)B为氮元素,D为硅元素;两元素可形成一种新型无机非金属化合物材料X,X为Si3N4,C为氯元素,C、D两元素形成的化合物Z为SiCl4,B的氢化物为NH3;Si3N4可由SiCl4与NH3在一定条件下制得,
反应方程式为3SiCl4+4NH3═Si3N4+12HCl.
故答案为:3SiCl4+4NH3═Si3N4+12HCl.
(4)B为氮元素,C为氯元素,两种元素组成的化合物Y,在常温下为易挥发的淡黄色液体,Y分子为三角锥形分子,且B、C两种原子最外层均达到8个电子的稳定结构,Y为NCl3,NCl3中氮原子与氯原子之间形成1对共用电子对,电子式为
 ;NCl3遇水蒸气可生成一种常见的漂白性物质,该物质为HClO,NCl3中Cl原子结合水中的-OH,N原子结合H原子生成NH3,所以NCl3与水反应产物的化学式为 NH3和HClO.
;NCl3遇水蒸气可生成一种常见的漂白性物质,该物质为HClO,NCl3中Cl原子结合水中的-OH,N原子结合H原子生成NH3,所以NCl3与水反应产物的化学式为 NH3和HClO.故答案为:
 ;NH3和HClO.
;NH3和HClO.点评:考查原子结构与位置关系、元素周期律、常用化学用语、化学计算等,综合性较大,难度中等,推断元素是解题关键,是对所学知识的综合运用,是一道不错的能力考查题.

练习册系列答案
相关题目
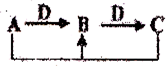 A、B、C、D是中学化学常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )
A、B、C、D是中学化学常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )| A、若D为H2O,A为碳,则A和C反应生成1 mol B转移的电子数为NA | ||
| B、若D为Fe,A为CI2,则B溶液蒸干后可得到纯净的B固体 | ||
| C、若D为O2,A为碱性气体,则以上转化只涉及两个氧化还原反应 | ||
D、若D为HCl,A为Na2CO3,则B溶液中c(Na+)=c(HCO3-)+2c(CO
|
 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.

 已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
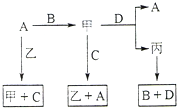 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空: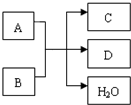 A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:
A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空: