摘要:20.一定条件下.AL密闭容器中放入1molN2和3molH2发生N2+2H22NH3的反应.下列选项中能说明反应已达到平衡状态的是( ) (A)c(N2): c(H2) : c(NH3)=1:3:2 (B)3v(H2)=v(N2) (C)单位时间内1个N≡N键断裂的同时.有6个N-H键断裂 (D)单位时间消耗0.1molN2的同时.生成0.2mol NH3 第II卷
网址:http://m.1010jiajiao.com/timu3_id_354849[举报]
(2011?南开区二模)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、M、R在周期表中的相对位置如表:J元素最低负化合价的绝对值与其原子最外层电子数相等.
请回答下列问题:
(1)M的离子结构示意图为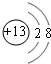
 ;元素R在周期表中位于第
;元素R在周期表中位于第
(2)J和氢组成的化合物分子有6个原子,其结构简式为
(3)M和T形成的化合物水溶液显
(4)L的最简单气态氢化物甲的水溶液显碱性.一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0并达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
(5)将T的气态单质通入冷的消石灰中可制得漂白粉,写出漂白粉溶液在空气中失效的化学方程式为
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
查看习题详情和答案>>
| J | ||||
| M | R |
(1)M的离子结构示意图为


ⅥA
ⅥA
族.(2)J和氢组成的化合物分子有6个原子,其结构简式为
CH2=CH2
CH2=CH2
.(3)M和T形成的化合物水溶液显
酸
酸
性,用离子方程式解释原因Al3++2H2O?Al(OH)3+3H+
Al3++2H2O?Al(OH)3+3H+
.(4)L的最简单气态氢化物甲的水溶液显碱性.一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0并达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
ad
ad
(选填序号).| 选项 | a | b | c | d |
| x | 温度 | 加入H2的物质的量 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
2HCl+O2↑
| ||
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
2HCl+O2↑
.
| ||
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
.(2012?顺义区二模)部分中学化学常见元素原子结构、性质及用途如下表:
请用化学用语回答下列问题:
(1)按A、B、C顺序,三种元素的金属性逐渐
(2)一定条件下,将4.0mol FE2和3.0mol E2 通入到体积为 2L的密闭容器中.反应达到平衡时,容器中为FE2 0.4mol,则此反应的平衡常数是.改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
a.增大压强 b.降低温度 c.使用催化剂 d.增大反应物的浓度
(3)E与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X和Y.
欲探究温度对Y分解速率的影响,应选择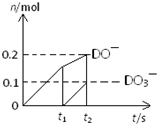
(4)一定量的石灰乳中通入一定量的D单质,两者恰好完全反应,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为
查看习题详情和答案>>
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
(1)按A、B、C顺序,三种元素的金属性逐渐
减弱
减弱
;用原子结构解释其原因Na、Mg、Al电子层数相同,核电荷数的递增,原子半径逐渐减小,原子核吸引电子能力增强,金属性减弱
Na、Mg、Al电子层数相同,核电荷数的递增,原子半径逐渐减小,原子核吸引电子能力增强,金属性减弱
.(2)一定条件下,将4.0mol FE2和3.0mol E2 通入到体积为 2L的密闭容器中.反应达到平衡时,容器中为FE2 0.4mol,则此反应的平衡常数是.改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
ad
ad
(填字母).a.增大压强 b.降低温度 c.使用催化剂 d.增大反应物的浓度
(3)E与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X和Y.
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
①②
①②
组实验;欲探究Y的浓度对分解速率的影响,请填写相关数据.
(4)一定量的石灰乳中通入一定量的D单质,两者恰好完全反应,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为
37g
37g
g,此时反应的方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
.A、B、C、D四种短周期元素的原子序数依次增大,A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐;B、C、D同周期,它们的最高价氧化物对应的水化物两两之间都能反应生成盐和水,B和D可组成化合物BD,回答下列问题.
(1)B的最高价氧化物对应的水化物与C的氧化物在溶液中反应的离子方程式为:
(2)B、D的最高价氧化物对应的水化物在稀溶液中反应,若生成0.25mol水时放出Q kJ的热量,则该反应的热化学方程式为
(3)在BHCO3的水溶液中,c(B+)-c(H2CO3)=
(4)在一定条件下,将2molA2和3molH2在一固定体积的密闭容器中反应达到平衡状态,此时容器中混合气体的平均相对分子质量为15.5,则H2的转化率为
查看习题详情和答案>>
(1)B的最高价氧化物对应的水化物与C的氧化物在溶液中反应的离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(2)B、D的最高价氧化物对应的水化物在稀溶液中反应,若生成0.25mol水时放出Q kJ的热量,则该反应的热化学方程式为
NaOH(aq)+HClO4(aq)=NaClO4(aq)+H2O(l)△H=-4QKJ/mol
NaOH(aq)+HClO4(aq)=NaClO4(aq)+H2O(l)△H=-4QKJ/mol
.(3)在BHCO3的水溶液中,c(B+)-c(H2CO3)=
c(Na+)-c(H2CO3)=C(HCO3-)+C(CO32-)
c(Na+)-c(H2CO3)=C(HCO3-)+C(CO32-)
.(4)在一定条件下,将2molA2和3molH2在一固定体积的密闭容器中反应达到平衡状态,此时容器中混合气体的平均相对分子质量为15.5,则H2的转化率为
50%
50%
.若平衡后,再按n(A2):n(H2):n(AH3)=3:3:2向该密闭容器中充入气体,当重新达到平衡后,A2在平衡混合气中的百分含量较原平衡小
小
(填“大”、“小”或“不变”).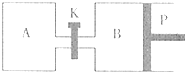 (2009?丹东模拟)甲醇可以与水蒸气反应生成氢气,反应方程式如下:
(2009?丹东模拟)甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容器密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为
0.01mol/L?s
0.01mol/L?s
.(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)
③④
③④
.①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH2OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应.
已知起始时容器A和B的体积均为aL.试回答:
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为
75%
75%
A、B两容器中H2O(g)的体积百分含量的大小关系为:B(填“>”、“<”、“=”)<
<
A.②若打开K,一段时间后重新达到平衡,容器B的体积为
1.75a
1.75a
L(连通管中气体体积忽略不计,且不考虑温度的影响).(1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是 92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是 .
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为 .向此溶液中加入少量的氯化铵固体,此时
值将 (填“增大”,“减小”或“不变”).
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH= 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
| 2 |
| 3 |
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为
c(N
| ||
| c(OH-) |
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=