摘要:24.中子星是恒星演化过程的一种可能结果.它的密度很大.现有一中子星.观测到它的自转周期为T=1/30s.向该中子星的最小密度应是多少才能维持该星体的稳定.不致因自转而瓦解.计等时星体可视为均匀球体.(引力常数G=6.67×10-11m3/kg·s2)
网址:http://m.1010jiajiao.com/timu3_id_35212[举报]
乳酸(CH3-CHOH-COOH)是人体生理活动的一种代谢产物,其聚合物(聚乳酸)是一种新型可生物降解的高分子材料,主要用于制造可降解纤维、可降解塑料和医用材料.如图是工业上用化学方法对乳酸进行加工处理的过程,其中F中含有两个-OH,且A、H、G为链状高分子化合物.
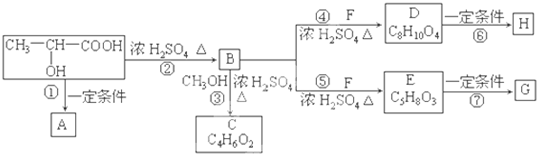
回答下列问题:
(1)写出下列物质的结构简式:C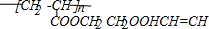
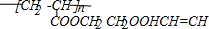 .
.
(2)上述反应①~⑦中,②是
(3)写出下列反应的化学方程式:
①
⑦
查看习题详情和答案>>

回答下列问题:
(1)写出下列物质的结构简式:C
CH2=CHCOOCH3
CH2=CHCOOCH3
,H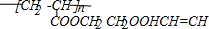
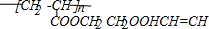
(2)上述反应①~⑦中,②是
消去反应
消去反应
反应,③是酯化或取代
酯化或取代
反应,⑥是加聚
加聚
反应.(填反应类型的名称)(3)写出下列反应的化学方程式:
①
2
 +2H2O
+2H2O

| 一定条件下 |
 +2H2O
+2H2O2
 +2H2O
+2H2O
.
| 一定条件下 |
 +2H2O
+2H2O⑦
nCH2=CHCOOCH2CH2OH

| 一定条件下 |

nCH2=CHCOOCH2CH2OH

.| 一定条件下 |

氧化还原反应包含氧化和还原两个过程.下面是一个还原过程的反应式:
NO
+4H++3e-═NO↑+2H2O;KMnO4、Na2CO3、FeO、Al(OH)3四种物质中的一种物质(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的离子方程式
(2)硝酸在该反应中的所体现的性质是
(3)如反应转移了0.6mol e-,则产生的气体在标准状况下体积为
查看习题详情和答案>>
NO
- 3 |
(1)写出并配平该氧化还原反应的离子方程式
3FeO+NO3-+10H+=3Fe3++NO↑+5H2O
3FeO+NO3-+10H+=3Fe3++NO↑+5H2O
.(2)硝酸在该反应中的所体现的性质是
氧化性;酸性
氧化性;酸性
.(3)如反应转移了0.6mol e-,则产生的气体在标准状况下体积为
4.48
4.48
L.(2011?兖州市三模)I.A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图1所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:

(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置
(2)写出反应④的离子方程式
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图2所示.
(1)电解池阳极的电极反应分别是①
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:CH4+4
-8e-=5CO2+2H2O
①正极的电极反应是
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是
(3)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)
查看习题详情和答案>>

(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置
第四周期、第Ⅷ族
第四周期、第Ⅷ族
,(2)写出反应④的离子方程式
2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑
.(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH
<
<
7(填“>”、“<”或“=”),用离子方程式表示其原因:NH4++H2O  NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O  NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图2所示.
(1)电解池阳极的电极反应分别是①
Fe-2e-=Fe2+
Fe-2e-=Fe2+
; ②4OH--4e-=2H2O+O2↑.(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:CH4+4
| CO | 2- 3 |
①正极的电极反应是
O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
.②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是
CO2
CO2
.(3)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)
11.2
11.2
L.我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.
(1)被称作海洋元素的是
(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式
(3)从海水中提取食盐和溴的过程如下: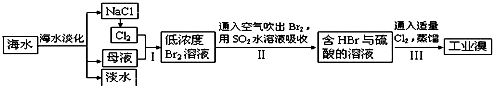
Ⅰ.①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为如图1中
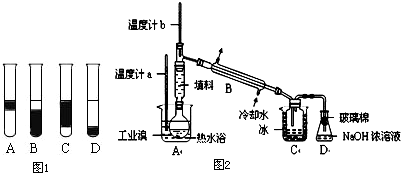
Ⅱ.某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,设计了如图2实验装置图.
请你参与分析讨论:
①实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中控制的关键条件是:
②C中液体产物颜色为
③整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为
④D装置的作用是
查看习题详情和答案>>
(1)被称作海洋元素的是
Br
Br
(写元素符号).(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式
Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO
Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO
,2HClO
2HCl+O2↑
| ||
2HClO
2HCl+O2↑
.
| ||
(3)从海水中提取食盐和溴的过程如下:

Ⅰ.①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,
SO2+Br2+2H2O═2HBr+H2SO4
SO2+Br2+2H2O═2HBr+H2SO4
.②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为如图1中
D
D
.
Ⅱ.某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,设计了如图2实验装置图.
请你参与分析讨论:
①实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中控制的关键条件是:
控制温度计b的温度,并且收集59℃时的馏分
控制温度计b的温度,并且收集59℃时的馏分
.②C中液体产物颜色为
深红棕色
深红棕色
,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr
NaBr
溶液,充分反应后,再进行的分离操作是萃取分液
萃取分液
.③整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为
溴单质具有强腐蚀性,会腐蚀橡胶
溴单质具有强腐蚀性,会腐蚀橡胶
.④D装置的作用是
除去少量有毒性的溴蒸汽,防止污染空气
除去少量有毒性的溴蒸汽,防止污染空气
.