题目内容
氧化还原反应包含氧化和还原两个过程.下面是一个还原过程的反应式:
NO
+4H++3e-═NO↑+2H2O;KMnO4、Na2CO3、FeO、Al(OH)3四种物质中的一种物质(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的离子方程式
(2)硝酸在该反应中的所体现的性质是
(3)如反应转移了0.6mol e-,则产生的气体在标准状况下体积为
NO
- 3 |
(1)写出并配平该氧化还原反应的离子方程式
3FeO+NO3-+10H+=3Fe3++NO↑+5H2O
3FeO+NO3-+10H+=3Fe3++NO↑+5H2O
.(2)硝酸在该反应中的所体现的性质是
氧化性;酸性
氧化性;酸性
.(3)如反应转移了0.6mol e-,则产生的气体在标准状况下体积为
4.48
4.48
L.分析:(1)根据物质中的元素的化合价处于低价时具有还原性,再根据电子守恒及质量守恒定律来配平化学反应方程式;
(2)根据硝酸中氮元素的化合价的变化来分析;
(3)该反应生成的气体为NO,然后利用化合价变化分析转移的电子数,由化合价变化的氮原子守恒来分析被还原的硝酸的物质的量,再利用反应来计算标准状况下NO体积;
(2)根据硝酸中氮元素的化合价的变化来分析;
(3)该反应生成的气体为NO,然后利用化合价变化分析转移的电子数,由化合价变化的氮原子守恒来分析被还原的硝酸的物质的量,再利用反应来计算标准状况下NO体积;
解答:解:(1)KMnO4、Na2CO3、FeO、Al(OH)3四种物质中,Mn、C、Fe元素都处在最高价,则具有氧化性,只有FeO中铁元素处在较低价,则具有还原性,在NO3-+4H++3e→NO+2H2O中发生的氧化剂被还原的反应,则该氧化还原反应为FeO+HNO3→NO↑+Fe(NO3)3+H2O,Fe元素由+2价升高到+3价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为3FeO+10HNO3═NO↑+3Fe(NO3)3+5H2O;离子方程式为:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O;
故答案为:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O;
(2)因硝酸中的N元素的化合价为+5价,NO中N元素的化合价为+2价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸铁与硝酸中N元素的化合价相同,则体现硝酸具有酸性;
故答案为:氧化性;酸性;
(3)3FeO+NO3-+10H+=3Fe3++NO↑+5H2O;反应中转移电子3mol时,生成一氧化氮气体1mol,则反应转移了0.6mol e-,则产生的气体物质的量为0.2mol,在标准状况下体积为4.48L;
故答案为:4.48L;
故答案为:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O;
(2)因硝酸中的N元素的化合价为+5价,NO中N元素的化合价为+2价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸铁与硝酸中N元素的化合价相同,则体现硝酸具有酸性;
故答案为:氧化性;酸性;
(3)3FeO+NO3-+10H+=3Fe3++NO↑+5H2O;反应中转移电子3mol时,生成一氧化氮气体1mol,则反应转移了0.6mol e-,则产生的气体物质的量为0.2mol,在标准状况下体积为4.48L;
故答案为:4.48L;
点评:本题考查了氧化还原反应的概念应用,电子守恒、电荷守恒、原子守恒的应用配平化学方程式,电子转移的计算应用.

练习册系列答案
相关题目
Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定
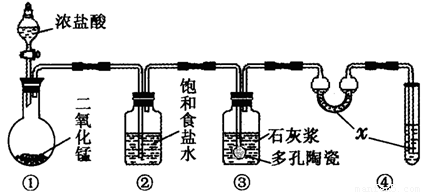
(1)装置④中的x试剂为 。
(2)装置③中发生反应的化学方程式为 。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是
_________________________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
实验测得数据如下表所示。
|
滴定次数 |
1 |
2 |
3 |
|
KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将 (填“偏高”、“偏低”或“无影响”)
 +4H++3e-═NO↑+2H2O;KMnO4、Na2CO3、FeO、Al(OH)3四种物质中的一种物质(甲)能使上述还原过程发生.
+4H++3e-═NO↑+2H2O;KMnO4、Na2CO3、FeO、Al(OH)3四种物质中的一种物质(甲)能使上述还原过程发生.