题目内容
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.
(1)被称作海洋元素的是
(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式
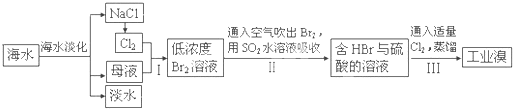
(3)从海水中提取食盐和溴的过程如下: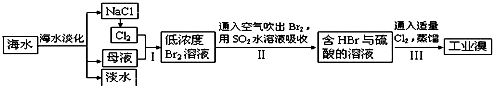
Ⅰ.①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为如图1中
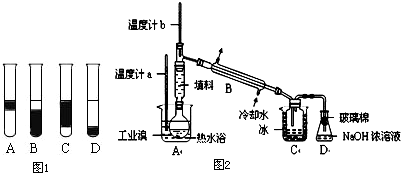
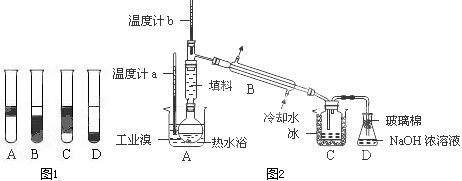
Ⅱ.某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,设计了如图2实验装置图.
请你参与分析讨论:
①实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中控制的关键条件是:
②C中液体产物颜色为
③整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为
④D装置的作用是
(1)被称作海洋元素的是
Br
Br
(写元素符号).(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式
Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO
Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO
,2HClO
2HCl+O2↑
| ||
2HClO
2HCl+O2↑
.
| ||
(3)从海水中提取食盐和溴的过程如下:

Ⅰ.①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,
SO2+Br2+2H2O═2HBr+H2SO4
SO2+Br2+2H2O═2HBr+H2SO4
.②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为如图1中
D
D
.
Ⅱ.某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,设计了如图2实验装置图.
请你参与分析讨论:
①实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中控制的关键条件是:
控制温度计b的温度,并且收集59℃时的馏分
控制温度计b的温度,并且收集59℃时的馏分
.②C中液体产物颜色为
深红棕色
深红棕色
,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr
NaBr
溶液,充分反应后,再进行的分离操作是萃取分液
萃取分液
.③整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为
溴单质具有强腐蚀性,会腐蚀橡胶
溴单质具有强腐蚀性,会腐蚀橡胶
.④D装置的作用是
除去少量有毒性的溴蒸汽,防止污染空气
除去少量有毒性的溴蒸汽,防止污染空气
.分析:(1)99%的溴元素以溴离子的形式存在于海洋中,被称为海洋元素;
(2)漂白粉的有效成分是次氯酸钙,他会和空气中的水以及二氧化碳发生反应生成具有漂白作用的次氯酸,但是次氯酸易分解;
(3)Ⅰ、①二氧化硫具有还原性,能被溴单质氧化为硫酸;
②四氯化碳和水是互不相溶的,密度比水大,溴单质在四氯化碳中的溶解度比在水中的大;
Ⅱ、①Br2的沸点为59℃,要获得溴蒸汽,控制液体的沸点温度是59℃;
②溴蒸汽易液化,液溴是深红棕色的液体,氯气可以和溴化钠反应生成溴单质和氯化钠,从溴水中获得纯溴,可以采用萃取分液法;
③溴单质具有氧化性,可以腐蚀橡胶;
④溴蒸汽有毒,氢氧化钠溶液可以和溴之间发生反应,生成溴化钠和次溴酸钠溶液.
(2)漂白粉的有效成分是次氯酸钙,他会和空气中的水以及二氧化碳发生反应生成具有漂白作用的次氯酸,但是次氯酸易分解;
(3)Ⅰ、①二氧化硫具有还原性,能被溴单质氧化为硫酸;
②四氯化碳和水是互不相溶的,密度比水大,溴单质在四氯化碳中的溶解度比在水中的大;
Ⅱ、①Br2的沸点为59℃,要获得溴蒸汽,控制液体的沸点温度是59℃;
②溴蒸汽易液化,液溴是深红棕色的液体,氯气可以和溴化钠反应生成溴单质和氯化钠,从溴水中获得纯溴,可以采用萃取分液法;
③溴单质具有氧化性,可以腐蚀橡胶;
④溴蒸汽有毒,氢氧化钠溶液可以和溴之间发生反应,生成溴化钠和次溴酸钠溶液.
解答:解:(1)99%的溴元素以溴离子的形式存在于海洋中,被称为海洋元素,
故答案为:Br;
(2)漂白粉的有效成分是次氯酸钙,会和空气中的水以及二氧化碳发生反应生成具有漂白作用的次氯酸,反应方程式为:Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO,但是次氯酸易分解2HClO
2HCl+O2↑,这样会导致漂白粉失效,
故答案为:Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;2HClO
2HCl+O2↑;
(3)Ⅰ、①二氧化硫具有还原性,能被溴单质氧化为硫酸,发生反应的方程式为:SO2+Br2+2H2O═2HBr+H2SO4,
故答案为:SO2+Br2+2H2O═2HBr+H2SO4;
②四氯化碳和水是互不相溶的,且密度比水大,化碳和水混合后会分层,下层是四氯化碳,溴单质在四氯化碳中的溶解度比在水中的大,溴将溶解在四氯化碳中.
故选:D;
Ⅱ、①根据题意信息:Br2的沸点为59℃,所以要获得溴蒸汽,可以控制蒸馏液体的温度是59℃,
故答案为:控制温度计b的温度,并且收集59℃时的馏分;
②溴蒸汽在59℃时被蒸馏出来,遇冷液化,所得的液溴是深红棕色的液体,如果其中含有氯气杂质,可以加入溴化钠来除杂,氯气可以和溴化钠反应生成溴单质和氯化钠,然后从混合液中获得纯溴,可以加入四氯化碳,采用萃取分液法,
故答案为:深红棕色;NaBr;萃取分液;
③因为溴单质具有氧化性,可以腐蚀橡胶,所以仪器连接均不能用橡胶塞和橡胶管,
故答案为:溴单质具有氧化性,可以腐蚀橡胶;
④溴蒸汽有毒,氢氧化钠溶液可以和溴之间发生反应,生成溴化钠和次溴酸钠溶液,可以用氢氧化钠来进行尾气处理,
故答案为:除去少量有毒性的溴蒸汽,防止污染空气.
故答案为:Br;
(2)漂白粉的有效成分是次氯酸钙,会和空气中的水以及二氧化碳发生反应生成具有漂白作用的次氯酸,反应方程式为:Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO,但是次氯酸易分解2HClO
| ||
故答案为:Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;2HClO
| ||
(3)Ⅰ、①二氧化硫具有还原性,能被溴单质氧化为硫酸,发生反应的方程式为:SO2+Br2+2H2O═2HBr+H2SO4,
故答案为:SO2+Br2+2H2O═2HBr+H2SO4;
②四氯化碳和水是互不相溶的,且密度比水大,化碳和水混合后会分层,下层是四氯化碳,溴单质在四氯化碳中的溶解度比在水中的大,溴将溶解在四氯化碳中.
故选:D;
Ⅱ、①根据题意信息:Br2的沸点为59℃,所以要获得溴蒸汽,可以控制蒸馏液体的温度是59℃,
故答案为:控制温度计b的温度,并且收集59℃时的馏分;
②溴蒸汽在59℃时被蒸馏出来,遇冷液化,所得的液溴是深红棕色的液体,如果其中含有氯气杂质,可以加入溴化钠来除杂,氯气可以和溴化钠反应生成溴单质和氯化钠,然后从混合液中获得纯溴,可以加入四氯化碳,采用萃取分液法,
故答案为:深红棕色;NaBr;萃取分液;
③因为溴单质具有氧化性,可以腐蚀橡胶,所以仪器连接均不能用橡胶塞和橡胶管,
故答案为:溴单质具有氧化性,可以腐蚀橡胶;
④溴蒸汽有毒,氢氧化钠溶液可以和溴之间发生反应,生成溴化钠和次溴酸钠溶液,可以用氢氧化钠来进行尾气处理,
故答案为:除去少量有毒性的溴蒸汽,防止污染空气.
点评:本体是一道涉及海水中的化学元素以及其化学性质的综合考查题,结合实验来考查,形式新颖,难度增大了.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目