题目内容
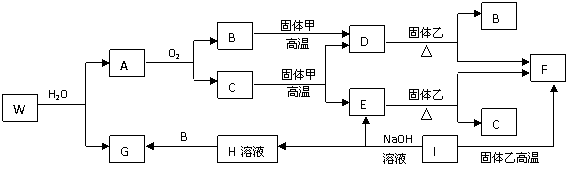
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,它们之间的相互转化关系如下图所示(部分产物及反应条件没有列出)。
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为________________;A与甲反应在工业上一个重要用途是________________。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式:________________;丙与乙反应的化学方程式:________________。
(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D通常状况下为气体,则进行下列研究:现将0.40 mol C和0.20 mol D充入

①若t1=10 min,则0至t1时间内C物质的平均反应速率为________________;该反应在t2时达到平衡,其化学反应方程式为________________。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是________________。
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
(1)2Al+2OH-+2H2O![]() 2
2![]() +3H2↑ 冶炼金属,野外焊接钢轨等(答对一项即可)
+3H2↑ 冶炼金属,野外焊接钢轨等(答对一项即可)
(2)H2S![]() H++HS-;HS-
H++HS-;HS-![]() H++S2- SO2+2H2S
H++S2- SO2+2H2S![]() 3S+2H2O
3S+2H2O
(3)①0.001 5 mol·L-1·min-1 N2+3H2![]() 2NH3 ②a
2NH3 ②a
解析:本题的突破口之一:A是一种能和NaOH溶液反应的常见金属,则根据中学化学知识可知A应为Al,C为H2;突破口之二:化合物甲是中学化学常见的红棕色粉末,则甲应为Fe2O3,则金属B应该为Fe;单质A与化合物甲的反应为铝热反应,主要用于金属的冶炼。
若乙的水溶液呈弱酸性,且化合物乙与非金属单质D燃烧时均生成有刺激性气味气体化合物丙,可知D应为S,乙为H2S,刺激性气味气体丙为SO2。
若化合物乙的水溶液呈碱性,又可作化肥,可知乙为NH3,其水溶液为氨水,可用作农业化肥;D为N2,化合物丙为NO。
从题目图示可看出,C、D为反应物,乙为生成物,三种物质化学式前面的化学计量数之比可由它们物质的量变化之比求出:C∶D∶乙=(0.40 mol-0.25 mol)∶(0.20 mol-0.15 mol)∶0.10 mol=3∶1∶2。即反应的化学方程式为:3H2+N2![]() 2NH3(注意题目中没显示反应条件)。
2NH3(注意题目中没显示反应条件)。
0—t1时物质C的平均反应速率为:![]() =0.001 5 mol· L-1·min-1。
=0.001 5 mol· L-1·min-1。
从题目图示还看出,在t1时,改变了某一反应条件C、D、乙三种物质的物质的量都发生了突变,然后快速达到了平衡状态,结合已有知识和题目给出的选项可知,引起这种改变的条件应该是加入了催化剂。

 阅读快车系列答案
阅读快车系列答案| A、燃烧一定要用火去点燃 | B、已知镓元素位于周期表中第4周期第ⅢA族,根据镓酸的酸性比偏铝酸强,所以镓的金属性比铝弱 | C、2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界.这一完美结合现实与理论的化学系统模型,为更全面了解并预测化学反应进程奠定了基础 | D、化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
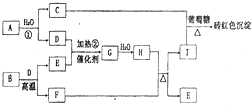 (2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
(2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,